
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是

A.称量 B.溶解 C.转移 D.定容
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考名师推荐化学盐类水解的概念与离子浓度大小比较(解析版) 题型:选择题
下列关于100mL 0.1mol/L Na2CO3溶液叙述中不正确的是
A.100mL 0.1mol/L Na2CO3溶液中含有CO32-的数目小于0.01NA
B.热的碳酸钠溶液比冷的碳酸钠溶液洗涤餐具效果好
C.用碳酸钠除去锅炉中的水垢(主要成分是CaSO4),使之转化为疏松、易溶于酸的碳酸钙。
D.100mL 0.1mol/L Na2CO3溶液中:n(CO32-)+n(HCO3-)+n(OH?)=0.01mol
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质结构与性质推断(解析版) 题型:填空题
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是 ,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是 ,原因是 。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式: 。
电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
A | 932 | 1 821 | 15 390 | 21 771 |
B | 738 | 1 451 | 7 733 | 10 540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,d0或d10排布无颜色,d1~d9排布有颜色。如[Co(H2O)6]2+显粉红色。据此判断:[Mn(H2O)6]2+ (填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为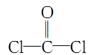 ,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。
,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键只有配位键,则形成的化学键类型是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的量及阿伏伽德罗常数(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.1 L 0.1 mol·L-1的氨水中含有NH3·H2O分子数为0.1NA
B.电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA
C.标准状况下,2.24 L的二氯甲烷中含有的碳氯共价键的数目为0.2NA
D.一定条件下,4.6 g NO2和N2O4混合气体中含有的N原子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的量及相关计算(解析版) 题型:选择题
在硫酸铝、硫酸钾和明矾的混合溶液中,如果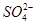 的浓度为0.2 mol·L-1,当加入等体积0.2 mol·L-1KOH溶液时,生成的沉淀恰好完全溶解,(忽略溶液中少量的H+和OH-)则反应后混合溶液中K+的浓度约是
的浓度为0.2 mol·L-1,当加入等体积0.2 mol·L-1KOH溶液时,生成的沉淀恰好完全溶解,(忽略溶液中少量的H+和OH-)则反应后混合溶液中K+的浓度约是
A.0.125 mol·L-1 B.0.225 mol·L-1
C.0.250 mol·L-1 D.0.450 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的检验(解析版) 题型:填空题
有一无色透明溶液,欲确定是否含有下列离子: Fe2+、Mg2+、Al3+、Ba2+、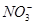 、
、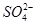 、Cl-、I-、
、Cl-、I-、 ,取该溶液进行实验:
,取该溶液进行实验:
实验步骤 | 实验现象 |
(1)取少量该溶液,加几滴紫色石蕊试液 | 溶液变红 |
(2)取少量该溶液加热,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气变成红棕色 |
(3)取少量该溶液,加BaCl2溶液 | 有白色沉淀 |
(4)取(3)中上层清液,加AgNO3溶液 | 有白色沉淀,且不溶于稀HNO3 |
(5)取少量该溶液,加NaOH溶液 | 有白色沉淀,NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定不存在的离子有 ,溶液中肯定存在的离子是 。
(2)请设计实验验证其中可能存在的阴离子的方法(写明操作、现象、结论) 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的分离和提纯(解析版) 题型:选择题
下列关于除去物质中杂质的方案设计,所选除杂试剂合理的是
| 主要物质 | 杂质 | 除杂试剂 |
A | SiO2 | Al2O3 | 盐酸 |
B | Si | C | 氧气 |
C | CO2 | SO2 | Na2CO3溶液 |
D | Cl2 | HCl | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氯、溴、碘及其化合物主要性质(解析版) 题型:填空题
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
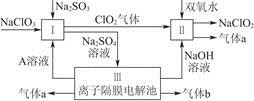
(1)双氧水的结构式为____________;Ⅰ中发生反应的还原剂是__________(填化学式)。
(2)Ⅱ中反应的离子方程式是_______________________________________。
(3)A的化学式是________,装置Ⅲ中A在________极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式:__________________________________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2。用离子方程式解释产生Cl2 的原因:__________________________________________。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量NaClO2,其中一份给以适当条件使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量________(填“相同”“不相同”或“无法判断”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com