
【题目】在密闭容器中通入物质的量浓度均为0.1的CH4与CO2 , 在一定条件下发生反应CH4(g)+CO2(g)2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示.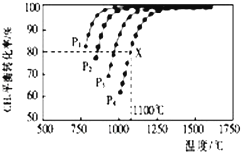
(1)据图可知,p1、p2、p3、p4由大到小的顺序是;
(2)在压强为p4、1100°C的条件下,该反应5min时达到平衡X点,反应的平衡常数为 .
【答案】
(1)P4>P3>P2>P1
(2)1.64
【解析】由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1 , 所以答案是:P4>P3>P2>P1;(2)由图可知,压强为P4、1100℃的条件下,达到平衡X点时甲烷的转化率为80%,甲烷的浓度变化量为0.1mol/L×80%=0.08mol/L,则:
CH4(g)+CO2(g)=2CO(g)+2H2(g),
开始(mol/L):0.1 0.1 0 0
变化(mol/L):0.08 0.08 0.16 0.16
平衡(mol/L):0.02 0.02 0.16 0.16
故该温度下平衡常数k= ![]() =1.64,
=1.64,
所以答案是:1.64.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】下列离子在水溶液中能大量共存的是( )
A. H+、K+、HCO3-、Ca2+ B. OH-、Na+、Mg2+、HCO3-
C. Na+、H+、Cl-、NO3- D. Na+、Si、H+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是生产某新型工程塑料的基础原料之一,结构简式为 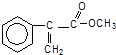 .
.
(1)写出A分子式的
(2)拟从芳香烃 ![]() 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下: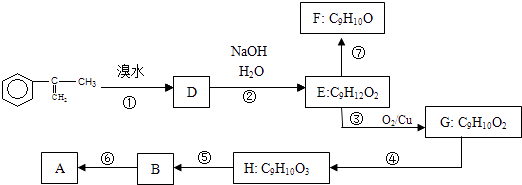
已知:A在酸性条件下水解生成有机物B和甲醇.
(a)写出⑤反应类型
(b)写出H的结构简式
(c)已知F分子中含有“﹣CH2OH”,通过F不能有效、顺利地获得B,其原因是
(d)写出反应方程式(注明必要的条件)⑦ . 两分子H之间发生反应生成六元环酯化学方程式是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2L的恒容密闭容器中加入0.2mol CO和0.4mol H2 , 发生如下反应:( )
CO(g)+2H2(g)CH3OH(g) 实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
甲醇物 时间 | 10min | 20min | 30min | 40min | 50min | 60min |
300℃ | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
500℃ | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
A.该反应的焓变△H>0,升高温度K增大
B.300℃时,0~20 min H2的平均反应速率 ν(H2)=0.003mol/(Lmin)
C.采取加压、增大H2浓度、加入催化剂的措施都能提高CO的转化率
D.500℃下,向该容器中初始加入0.1 mol CO和0.3 mol H2 , 依据现有数据可计算出反应达平衡后甲醇的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应(表示物质均为反应物)中,反应刚开始时,放出氢气速率最大的是( )
编号 | 金属(块状) | 酸的浓度及体积 | 反应温度(℃) |
A | 0.2mol Mg | 10 mL2.5 mol·L-1硫酸 | 60 |
B | 0.2mol Mg | 40 mL3 mol·L-1盐酸 | 60 |
C | 0.2mol Fe | 50 mL5 mol·L-1盐酸 | 60 |
D | 0.2mol Mg | 20 mL2.5 mol·L-1硫酸 | 50 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值.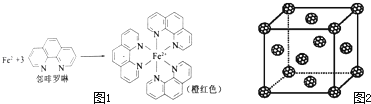
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰.相关的反应如下:4FeCl3+2NH2OHHCl→4FeCl2+N2O↑+6HCl+H2O
①Fe2+在基态时,核外电子排布式;
①羟胺中(NH2OH)采用SP3杂化的原子有;
③Fe2+与邻啡罗啉形成的配合物中,配位数为;
(2)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体,该晶体中含有的化学键类型是;
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+ , 已知NF3与NH3的空间构型都是三角锥形,但NF3 不易与Cu2+形成配离子,其原因是;
(4)配合物Ni(CO)4常温下呈液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于晶体;
(5)如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C60 晶体的空隙中,形成具有良好的超导性的掺杂C60 化合物.现把C60抽象成质点,该晶体的晶胞结构如图2所示,若每个四面体空隙填入一个原子,则全部填满C60 晶体的四面体空隙后,所形成的掺杂C60 化合物的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及部分重要化合物的相互转化如图所示.
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是;
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol/L CuSO4溶液所能氧化的白磷的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是
①该物质属于芳香族化合物
②该有机物的分子式为C15H18O3
③该物质所有的碳原子一定在同一个平面上
④遇FeCl3溶液呈紫色,因为该物质与苯酚属于同系物
⑤1mol该化合物最多可与3mol NaOH发生反应
⑥1mol该化合物最多可与含3molBr2的溴水发生取代反应( )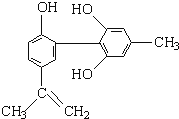
A.①⑤⑥
B.①④⑤
C.①④⑥
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用一定浓度的氨水滴定一定体积未知浓度的土壤浸出溶液,溶液的pH变化与滴入氨水体积的关系如图所示,下列有关说法不正确的是( )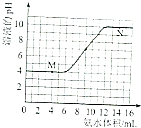
A.该土壤是酸性土壤
B.当溶液中c(H+)=c(OH﹣)时,消耗氨水的体积为9mL
C.M、N点由水电离出的氢离子浓度一定相等
D.将20mL此氨水与10mL同浓度的盐酸混合,充分反应后存在:C(NH4+)>c(Cl﹣)>c(NH3H2O)>c(OH﹣)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com