


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
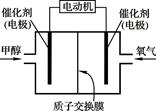
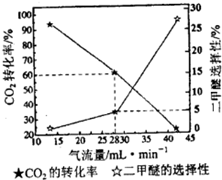
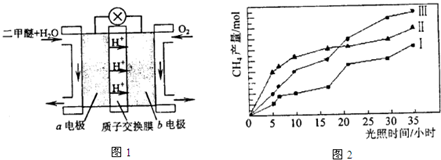
 据新浪网报道:2010年8月19日在东川“味永佳”餐馆吃过晚饭的6个人,两天后却相继躺到了省红会医院的病床上,诊断均为甲醇中毒.甲醇是一种无色、透明、易燃、易挥发的有毒液体,略有酒精气味,误饮5~10毫升能双目失明,大量饮用会导致死亡.
据新浪网报道:2010年8月19日在东川“味永佳”餐馆吃过晚饭的6个人,两天后却相继躺到了省红会医院的病床上,诊断均为甲醇中毒.甲醇是一种无色、透明、易燃、易挥发的有毒液体,略有酒精气味,误饮5~10毫升能双目失明,大量饮用会导致死亡.| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省沈阳二中高二下学期期中考试化学试卷(带解析) 题型:填空题
Ⅰ 氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布图是_________________。
(2)C、N、O 三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4mol N-H 键断裂,则形成的π 键有________mol。
Ⅱ 金属镍在电池、合金、催化剂等方面应用广泛。
(4)第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是______。
(5)甲醛(H2C=O)在Ni 催化作用下加氢可得甲醇(CH3OH)。甲醛分子内C 原子的杂化方式为________。
Ⅲ 氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(6)写出N2H62+与碱溶液反应的离子方程式 ;
(7)写出N3-等电子体物质的化学式 ;(一种)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省新海高级中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(8分)甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。
已知:CH3OH(1) + O2(g) =" CO(g)" + 2H2O(g) △H = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) △H =-566.0 kJ·mol-1
(1)试写出2molCH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:
(2)科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题:
甲醇在 极反应;O2一极发生的电极反应方程式为
(3)若用该电池在某金属表面镀铜,若待镀金属的质量增加了6.4g,则至少消耗甲醇的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2014届辽宁省高二下学期期中考试化学试卷(解析版) 题型:填空题
Ⅰ 氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布图是_________________。
(2)C、N、O 三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4mol N-H 键断裂,则形成的π 键有________mol。
Ⅱ 金属镍在电池、合金、催化剂等方面应用广泛。
(4)第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是______。
(5)甲醛(H2C=O)在Ni 催化作用下加氢可得甲醇(CH3OH)。甲醛分子内C 原子的杂化方式为________。
Ⅲ 氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(6)写出N2H62+与碱溶液反应的离子方程式 ;
(7)写出N3-等电子体物质的化学式 ;(一种)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com