
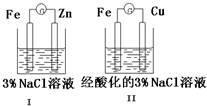
| A. | Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-═4OH- | |
| B. | Ⅰ和Ⅱ中负极反应均是Fe-2e-═Fe2+ | |
| C. | Ⅰ和Ⅱ中正极均被保护 | |
| D. | Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀产生 |
分析 锌比铁活泼,装置Ⅰ中锌做负极,负极反应为:Zn-2e-=Zn2+,铁做正极,溶液呈中性,发生吸氧腐蚀,正极反应为:O2+2H2O+4e-=4OH-;铁比铜活泼,装置Ⅱ中铁为负极,反应式为:Fe-2e-=Fe2+,正极为铜,电解质溶液呈酸性,所以正极的反应式为:2H++2e-=H2↑;检验Fe2+离子可用K3[Fe(CN)6]生成蓝色的Fe3[Fe(CN)6]2沉淀.
解答 解:A、I溶液显中性,其电极反应式为:O2+2H2O+4e-=4OH-,而II溶液显酸性,电极反应式为:2H++2e-=H2↑,故A错误;
B、I中的负极反应式为:Zn-2e-=Zn2+,而II中负极是铁,反应式为:Fe-2e-=Fe2+,故B错误;
C、题给装置I、II都是原电池,活泼金属作负极,首先被腐蚀,不活泼金属作正极,被保护;故A正确;
D、I中没有Fe2+,不能与K3[Fe(CN)6]生成蓝色的Fe3[Fe(CN)6]2沉淀,故D错误;
故选C.
点评 本题考查原电池的工作原理以及金属的腐蚀及防护等知识,做题的关键是正确判断电池的正负极反应.


科目:高中化学 来源: 题型:选择题
| A. | 1molNaCl固体溶于1L水所得溶液中NaCl的物质的量浓度为1mol•L-1 | |
| B. | 2.3g钠转化为钠离子时得到的电子数目为0.1NA | |
| C. | 常温常压下,11.2L 甲烷中所含的氢原子数为2NA | |
| D. | 32g O2和O3混合气体所含的原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3均为电解质 | |
| B. | 升高温度能够增大单位体积内活化分子百分数,从而加快反应速率 | |
| C. | 中和热测定实验中需要用到的玻璃仪器有烧杯、温度计和量筒三种 | |
| D. | 强电解质的导电能力一定比弱电解质强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质:盐酸、氢氧化钡、明矾 | |
| B. | 纯净物:冰水混合物;含氧40%的氧化镁 | |
| C. | 有单质参加和单质生成的化学反应一定是氧化还原反应 | |
| D. | 同位素:H2、D2、T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率相等 | |
| B. | 氢气与氮气能够缓慢地反应生成氨气,使用合适催化剂可以提高化学反应的转化率 | |
| C. | 用铁片与硫酸制备氢气时,滴加CuSO4溶液可以加快产生氢气的速率 | |
| D. | 二氧化硫的催化氧化反应的△H<0,所以升高温度,反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | M | N | P |
| A | NH3•H2O | Ba(OH)2 | Cu |
| B | Na | BaCl2 | FeO |
| C | NaOH | Ba(NO3)2 | Fe |
| D | Na2O | MgCl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②⑤ | C. | ③④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | Na2CO3溶液中通入少量CO2:CO32-+CO2+H2O═2HCO3- | |
| C. | 金属Na与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | H2SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com