
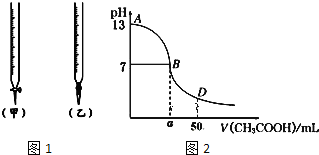
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 石蕊 | (乙) |
滴定次数 | 待测氢氧化钠溶液 的体积(ml) | 0.100mol/L醋酸的体积 | |
| 滴定前的刻度(ml) | 滴定后的刻度(ml) | ||
| 第一次 | 25.00 | 0.00 | 24.98 |
| 第二次 | 25.00 | 1.56 | 27.86 |
| 第三次 | 25.00 | 0.22 | 25.24 |
| c(标准)V(标准) |
| V(待测) |
| c(标准)V(标准) |
| V(待测) |
| c(标准)V(标准) |
| V(待测) |
| c(标准)V(标准) |
| V(待测) |
| c(标准)V(标准) |
| V(待测) |


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
| A、1 mol任何气体的体积都约是22.4 L |
| B、标准状况时,氧气的体积约是22.4 L |
| C、1 molH2和1 molH2O在标准状况下体积都约是22.4 L |
| D、1 mol任何气体在标准状况下所占体积都约是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
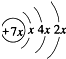 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | C | 75.0 | d |
| 1000 | e | f | 83.0 |
| A、1个 | B、2个 | C、3个 | D、4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
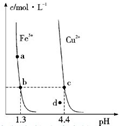 某温度下,Fe (OH)3(s)、Cu (OH)2 (s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是( )
某温度下,Fe (OH)3(s)、Cu (OH)2 (s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是( )| A、Ksp〔Fe (OH)3〕<Ksp〔Cu (OH)2〕 |
| B、加适量NH4Cl固体可使溶液由a 点变到b点 |
| C、c、d两点代表的溶液中c(H+) 与c(OH-)乘积相等 |
| D、Fe (OH)3、Cu (OH)2分别在b、c两点代表的溶液中达到饱和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
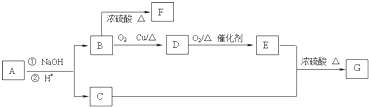
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
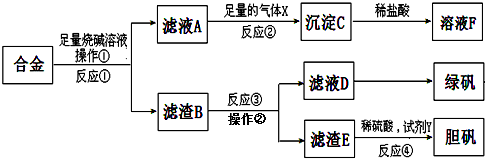
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com