
某化学课外活动小组通过实验研究NO2的性质.
已知:2NO2+2NaOH═NaNO3+NaNO2+H2O
利用图1所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)
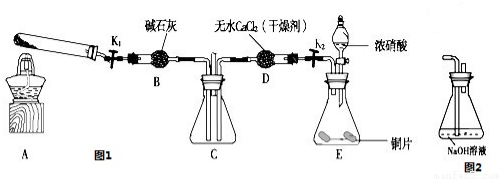
(1)E装置中制取NO2反应的离子方程式是
(2)该实验中制取氨气时若只用一种试剂,从下列物质中选取 ( )
a.NH4HCO3 b.NH4Cl c.浓氨水
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是
(4)此实验装置存在一个明显的缺陷是
(5)探究NO2能否与Na2O2发生氧化还原反应.为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图2所示),重新组装,进行实验.装置的合理连接顺序是
(6)实验过程中,B装置中淡黄色粉末逐 渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成.推测B装置中反应的化学方程式为
(1) Cu+4H++2NO3-═Cu2++2NO2↑+2H2O (2) a (3)C装置中混合气体颜色变浅
(4)缺少尾气吸收装置 (5)EDBDF或EDBF或FDBDE或FBDE 2NO2+Na2O2═2NaNO3
【解析】
试题分析:(1)浓硝酸与Cu反应的离子方程式为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O 。(2)用一种固体物质加热制取NH3,要用a NH4HCO3分解的方法。NH4HCO3 NH3↑+H2O+ CO2↑.不能用加热NH4Cl的方法。因为:NH4Cl
NH3↑+H2O+ CO2↑.不能用加热NH4Cl的方法。因为:NH4Cl NH3↑+HCl↑。在试管口二者又重新化合生成NH4Cl。NH3+HCl =NH4Cl。最终得不到氨气。(3)若NO2能够被NH3还原,预期观察到C装置中的现象是由于消耗红棕色的NO2气体,使得C装置中混合气体颜色变浅。(4)由于NH3、NO2都是你大气污染物,所以此实验装置存在一个明显的缺陷是缺少尾气吸收装置。(5)探究NO2能否与Na2O2发生氧化还原反应,重新组装,进行实验.装置的合理连接顺序是EDBDF或EDBF或FDBDE或FBDE,(6)根据元素的原子个数守恒和电子守恒的知识,结合题干已知条件可推测B装置中反应的化学方程式为2NO2+Na2O2═2NaNO3。
NH3↑+HCl↑。在试管口二者又重新化合生成NH4Cl。NH3+HCl =NH4Cl。最终得不到氨气。(3)若NO2能够被NH3还原,预期观察到C装置中的现象是由于消耗红棕色的NO2气体,使得C装置中混合气体颜色变浅。(4)由于NH3、NO2都是你大气污染物,所以此实验装置存在一个明显的缺陷是缺少尾气吸收装置。(5)探究NO2能否与Na2O2发生氧化还原反应,重新组装,进行实验.装置的合理连接顺序是EDBDF或EDBF或FDBDE或FBDE,(6)根据元素的原子个数守恒和电子守恒的知识,结合题干已知条件可推测B装置中反应的化学方程式为2NO2+Na2O2═2NaNO3。
考点:考查NH3、NO2的实验室制法及NO2的化学性质的探究。


科目:高中化学 来源:2016届贵州省高一上学期期中考试化学试卷(解析版) 题型:选择题
若1gN2含a个分子,则阿伏加德罗常数可表示为
A.a/28mol-1 B.a mol-1 C.28a mol-1 D.a/14 mol-1
查看答案和解析>>
科目:高中化学 来源:2016届福建省宁德市高一上学期期末考试化学试卷(A)(解析版) 题型:选择题
除去混在Na2CO3粉末中的少量NaHCO3,下列最合理的方法是
A.加入适量NaOH溶液 B.加热到固体质量不变
C.加入适量HCl溶液 D.加入适量CaCl2溶液
查看答案和解析>>
科目:高中化学 来源:2016届福建省四地六校高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是( )
A.铁与稀硝酸反应:Fe+2H+=Fe2++H2↑
B.用氨水吸收少量的SO2: NH3·H2O +SO2=NH4++HSO3-
C.用小苏打治疗胃酸过多:HCO3-+H+ = CO2↑+H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu = Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源:2016届福建省四地六校高一下学期第一次月考化学试卷(解析版) 题型:选择题
科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法中正确的是 ( )
A.自然界硅的贮量丰富
B.自然界中存在大量单质硅
C.二氧化硅被用于制作计算机芯片
D.光导纤维的主要成分是Si
查看答案和解析>>
科目:高中化学 来源:2016届福建省厦门市高一上学期期末质量检测模拟化学试卷(解析版) 题型:选择题
工业废气NO、NO2是造成大气污染的气体之一,工业上常用原理为NOx + NH3→N2 + H2O,使其转化为无毒的N2,现有NO、NO2的混合3.0L,可与3.5L相同状况的NH3完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是( )
A.1:1 B.1:3 C.3:1 D.2:1
查看答案和解析>>
科目:高中化学 来源:2016届福建省厦门市高一上学期期末质量检测模拟化学试卷(解析版) 题型:选择题
从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳; ②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物; ③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物; ④将得到的产物熔融电解得到镁。下列说法不正确的是( )
A.此法的优点之一是原料来源丰富 B.①②③步骤的目的是从海水中提取MgCl2
C.提取镁的过程中没有氧化还原反应 D.第④步电解时同时产生氯气
查看答案和解析>>
科目:高中化学 来源:2016届福建省高一上学期期中考试化学试卷(解析版) 题型:实验题
用质量分数为98%,密度为1.84g· cm-3的浓硫酸配制250mL物质的量浓度为2mol·L-1的稀硫酸。
(1)需要使用的主要仪器有量筒、烧杯、玻璃棒、 、 。
(2)其操作步骤可分解为以下几步:
A.用量筒量取 mL浓硫酸, (简述浓硫酸的稀释操作),冷却
B.用蒸馏水洗涤烧杯和玻璃棒2~3次,将每次的洗涤液都转移入容量瓶里
C.将稀释后的硫酸小心地用玻璃棒引流至容量瓶里
D.检查250mL容量瓶是否漏水
E.将蒸馏水直接加入容量瓶至刻度线以下2cm处
F.盖紧瓶塞,上下倒转摇匀溶液
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到凹液面最低点恰好与刻度线相切
请据此填写:
①完成上述步骤中的空白处。
②正确的操作顺序是(用字母填写):
( )→( )→( )→ B →( )→( )→( )
③进行A步操作时,选用量筒的规格是 。(选填字母)
A.10mL B.50mL C.100mL D.1000mL
④下列情况对所配制的稀硫酸浓度有何影响?(选填“偏高”、“偏低”、“无影响”)。
A.用量筒量取浓硫酸时仰视,配制的稀硫酸浓度将
B.容量瓶用蒸馏水洗涤后残留有少量的水_________
C.定容时仰视溶液的凹液面 _________
查看答案和解析>>
科目:高中化学 来源:2016届福建省南平市高一上学期期末考试化学试卷(解析版) 题型:选择题
食盐、纯碱、食醋均为厨房中常用的物质,利用这些物质不能实现的实验是
①除去热水瓶内壁的水垢
②检验自来水中是否含有氯离子
③鉴别食盐和纯碱
④检验食盐中是否含有碘
A.①③ B.②③ C.②④ D.①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com