
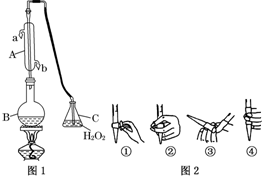
 中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.
中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.分析 (1)根据仪器A特点书写其名称,为了充分冷却气体,应该下口进水;
(2)二氧化硫具有还原性,能够与实验室反应生成硫酸,据此写出反应的化学方程式;
(3)氢氧化钠应该盛放在碱式滴定管中,根据碱式滴定管的排气泡法进行判断;根据滴定终点时溶液的pH及常见指示剂的变色范围选用正确的指示剂;根据滴定管的构造判断滴定管中溶液的体积;
(4)根据关系式2NaOH~H2SO4~SO2及氢氧化钠的物质的量计算出二氧化硫的质量,再计算出该葡萄酒中的二氧化硫含量;
解答 解:(1)根据仪器A的构造可知,仪器A为冷凝管,冷凝管中通水方向采用逆向通水法,冷凝效果最佳,所以应该进水口为b,
故答案为:冷凝管或冷凝器;b;
(2)双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4,
故答案为:SO2+H2O2=H2SO4;
(3)氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用③的方法;滴定终点时溶液的pH=8.8,应该选择酚酞做指示剂(酚酞的变色范围是8.2~10.0);若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有40mL有刻度的溶液,另外滴定管50mL刻度线下有液体,因此管内的液体体积>(50.00mL-10.00mL)=40.00mL,所以④正确,
故答案为:③;酚酞;④;
(4)根据2NaOH~H2SO4~SO2可知SO2的质量为:$\frac{1}{2}$×(0.0900mol/L×0.025L)×64g/mol=0.072g,该葡萄酒中的二氧化硫含量为:$\frac{0.072g}{0.3L}$=0.24g/L,
故答案为:0.24.
点评 本题为一道高考题,考查了探究物质的组成、测量物质的含量的方法,题目难度中等,试题涉及了二氧化硫性质、中和滴定的计算,要求学生掌握探究物质组成、测量物质含量的方法,明确二氧化硫的化学性质及中和滴定的操作方法及计算方法,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 结构示意图为 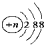 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| B. | 球棍模型为  的分子可发生加成反应 的分子可发生加成反应 | |
| C. | 邻硝基甲苯的结构简式为 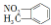 ,能发生取代反应 ,能发生取代反应 | |
| D. | 电子式分别为  和 和 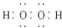 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 组成该晶体的微粒为分子 | |
| B. | 1mol该晶体中有2mol共价键 | |
| C. | 该二氧化碳晶体和干冰存在的作用力完全相同 | |
| D. | 一定条件下该晶体能与氢氧化钠反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 腐蚀电路板的反应为:Cu+2FeCl3═CuCl2+2FeCl2
腐蚀电路板的反应为:Cu+2FeCl3═CuCl2+2FeCl2查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+2NaOH═Na2CO3+H2O | B. | CO2+C(红热)═2CO | ||
| C. | CO2+Ca(OH)2═CaCO3+H2O | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和稀硝酸反应 Cu+4H++NO3-=Cu2++2H2O+NO↑ | |
| B. | 碳酸氢钠和过量的澄清石灰水反应 2HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+CO32- | |
| C. | Fe投入盐酸中 2Fe+6H+=2Fe3++3H2↑ | |
| D. | 氢氧化铝溶于氢氧化钠溶液 Al(OH)3+OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com