
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 6 | 4 | x |
分析 ①任何电解质溶液中都存在电荷守恒,根据电荷守恒计算硫酸根离子浓度;
②用石墨作电极时,阴极上先铜离子放电生成Cu,然后氢离子放电生成氢气;阳极上氯离子放电生成氯气,然后氢氧根离子放电生成氧气,根据转移电子守恒计算阳极生成氧气的物质的量.
解答 解:①任何电解质溶液中都存在电荷守恒,根据电荷守恒得2c(Cu2+)+c(H+)=2 c(SO42-)+c(Cl-),c(SO42-)=$\frac{2×1+6-4}{2}$mol/L=2mol/L,
故答案为:2;
②用石墨作电极电解该溶液时,阴极上铜离子先放电后氢离子放电,n(Cu2+)=1mol/L×0.1L=0.1mol,0.1mol铜离子放电转移0.2mol电子,生成氢气转移电子的物质的量=2n(H2)=2×0.3mol=0.6mol,所以阴极上转移0.8mol电子;
阳极上先氯离子放电生成氯气,氯离子完全放电转移电子物质的量=2n(Cl2)=2×$\frac{1}{2}$n(Cl-)=2×$\frac{1}{2}$×4mol/L×0.1L=0.4mol,根据转移电子守恒知,阳极上还转移0.4mol电子生成氧气,根据4OH--4e-=2H2O+O2↑知,
转移电子物质的量是生成氧气的4倍,所以生成氧气物质的量=$\frac{0.4mol}{4}$=0.1mol,
故答案为:0.1.
点评 本题考查电解原理,为高频考点,侧重考查学生分析计算能力,明确离子放电顺序及转移电子守恒是解本题关键,注意生成氧气和转移电子的关系,为易错点.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ① | C. | ② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
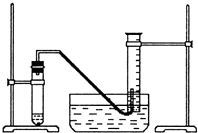 某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL).实验装置如下:
某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL).实验装置如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有氧化性、无还原性、无酸性 | B. | 无氧化性、有还原性、无酸性 | ||
| C. | 有氧化性、有还原性、有酸性 | D. | 有氧化性、无还原性、有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
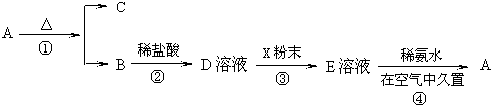
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
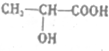 .
.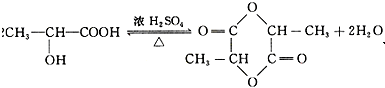 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
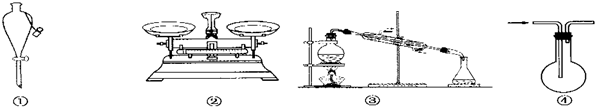
| A. | 仪器①可用于乙醇与水分离提纯 | |
| B. | 仪器②可用于称取5.85 g氯化钠固体 | |
| C. | 装置③的烧瓶中应加沸石,以防暴沸 | |
| D. | 装置④从箭头方向进气,用排空气法可收集H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com