
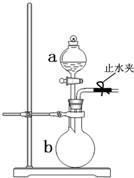
 如图所示装置是实验室常用的气体制取装置.据图回答下列问题:
如图所示装置是实验室常用的气体制取装置.据图回答下列问题:分析 (1)由装置图可知,a为分液漏斗;关闭活塞,打开止水夹,将导管放入水中,使装置形成密闭系统,结合气体热胀冷缩原理分析;
(2)实验室用饱和食盐水与碳化钙来制备乙炔;浓氨水与生石灰混合制备氨气;同时制取NH3和O2,可以用过氧化钠与浓氨水混合.
解答 解:(1)由装置图可知,a为分液漏斗;关闭活塞,打开止水夹,将导管放入水中,使装置形成密闭系统,加热圆底烧瓶,气体体积膨胀,则导管口会有气泡冒出,冷却后形成水柱,则装置气密性良好;
故答案为:a为分液漏斗;关闭活塞,打开止水夹,将导管放入水中,加热圆底烧瓶,若导管口有气泡冒出,冷却后形成水柱,则装置气密性良好;
(2)实验室用饱和食盐水与碳化钙来制备乙炔,圆底烧瓶b中固体为碳化钙,则分液漏斗a中盛放的药品为饱和食盐水;若制取氨气且a中盛放的药品为浓氨水,则b中固体为生石灰,生石灰与水反应放出大量的热,同时生成碱,使氨水挥发出大量的氨气;Na2O2与水反应生成氧气和氢氧化钠,同时放出大量的热,若同时制取NH3和O2,可以用过氧化钠与浓氨水混合;
故答案为:饱和食盐水;生石灰;Na2O2.
点评 主要考查了常用气体的发生装置的选取方法,掌握实验室制取乙炔、氨气、氧气和二氧化碳等气体的反应原理和实验装置是解题的关键,侧重于考查学生的实验能力,题目难度不大.


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中含有0.6NA个K+ | |
| B. | 1L溶液中含有K+和SO42-总数为0.9NA | |
| C. | 取出10mL该溶液中,K+浓度为0.3mol/L | |
| D. | 100mL溶液中含有SO42-数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯水的导电性很差,所以水不是电解质 | |
| B. | SO2水溶液的导电性很好,所以SO2是电解质 | |
| C. | 熔融状态时铜的导电性很好,所以铜是电解质 | |
| D. | 硝酸钾在水中和熔融状态时都能导电,所以硝酸钾是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH2O含有的氢原子数目为NA | |
| B. | 标准状况下,22.4LCO2含有的分子数目为NA | |
| C. | 常温常压下,1.06gNaCO3含有的分子数目为0.02NA | |
| D. | 1L1mol/L的KClO3溶液中含有的Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据u,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据u,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①为氧化还原反应,反应②为复分解反应 | |
| B. | 反应①中NaClO 是氧化剂 | |
| C. | Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒 | |
| D. | 若有2 mol FeCl3 发生反应,转移电子的物质的量为 6 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com