
| A. | 煤的气化、液化和干馏的过程都没有涉及化学变化 | |
| B. | 石油分馏产品中重油进行催化裂化,可提高汽油等轻质油的产量和质量 | |
| C. | 天然气和沼气的主要成分相同,都是甲烷 | |
| D. | 氢气的热值比汽油高,是理想的清洁燃料和绿色能源 |
分析 A.煤的气化、液化、干馏都是化学变化;
B.催化裂化是为了提高从石油得到的汽油等轻质油的产量和质量;
C.甲烷是天然气和沼气的主要成分;
D.氢气的燃烧产物是水,属于清洁能源.
解答 解:A.煤的气化是煤在氧气不足的条件下进行部分氧化形成H2、CO等气体的过程.煤的液化是将煤与H2在催化剂作用下转化为液体燃料或利用煤产生的H2和CO通过化学合成产生液体燃料或其他液体化工产品的过程,干馏是隔绝空气加强热辐射化学反应,故A错误;
B.石油的催化裂化是为了提高从石油得到的汽油等轻质油的产量和质量,故B正确;
C.天然气和沼气的主要成分是甲烷,故C正确;
D.氢气的燃烧产物是水,无污染,属于清洁能源,故D正确;
故选A.
点评 本题考查了物质变化的分析判断,注意知识的积累,题目难度不大.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:解答题
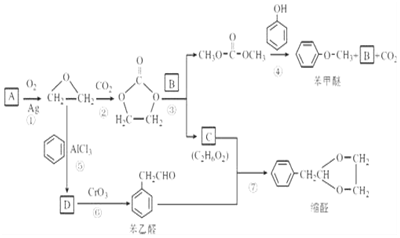
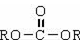 $\stackrel{2R′OH}{→}$2ROH+
$\stackrel{2R′OH}{→}$2ROH+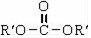
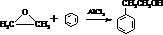 .
.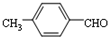 、
、 .
. 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备 的合成路线(须注明必要的反应条件)
的合成路线(须注明必要的反应条件)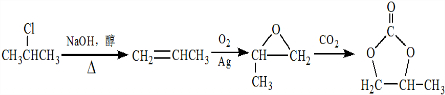 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl晶体 | B. | Zn粉 | C. | SO3固体 | D. | CuSO4晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L - 1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L - 1KOH溶液,下列说法中正确的是( )| A. | 放电时K +移向负极 | |
| B. | 放电时电池负极的电极反应为H 2-2e -═2H + | |
| C. | 放电时电池正极的电极反应为NiO(OH)+H 2O+e -═Ni(OH) 2+OH - | |
| D. | 该电池充电时将碳电极与电源的正极相连,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 浓度均为0.1 mol/L的四种溶液中由水电离出的H+浓度由大到小的顺序是:氯化铵、醋酸、硫酸、氢氧化钠 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.某溶液中含有Cl-和CrO42-,浓度均为0.010mol•L-1,向该溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先沉淀 | |
| D. | 25℃时,取0.2mol•L-1 HClO溶液与0.2mol•L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(ClO-)=9.9×10-7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应可以被人类利用,而吸热反应无利用价值 | |
| B. | 当反应物总能量高于生成物总能量的时候,反应可能放热也可能吸热 | |
| C. | 非自发进行的反应一定不能发生 | |
| D. | 同种物质在气态时熵值最大,固体时最小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com