
| A、27g铝的原子最外层电子总数为NA |
| B、2.8 g N2和2.8 g CO所含电子数均为1.4NA |
| C、1L0.1mol?L-1乙酸溶液中H+数为0.1NA |
| D、标准状况下,22.4L乙醇的分子数为NA |


科目:高中化学 来源: 题型:
| A、测定相同温度下盐酸和醋酸溶液的pH,可证明盐酸是强酸、醋酸是弱酸 |
| B、改变温度能改变任何可逆反应的平衡状态 |
| C、离子反应的结果是自由移动的离子浓度减小 |
| D、Fe(OH)3胶体和饱和FeCl3溶液都呈红褐色,可通过丁达尔效应区分二者 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5在空气中形成了气溶胶 |
| B、同温同压条件下,等质量的氧气和臭氧体积比为2:3 |
| C、16g臭氧中含有NA个原子 |
| D、1.00 mol臭氧中含有电子总数为18NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
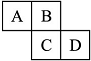 如图是元素周期表的一部分.A、B、C、D均为短周期元素,若C原子最外层电子数是其内层电子数的
如图是元素周期表的一部分.A、B、C、D均为短周期元素,若C原子最外层电子数是其内层电子数的| 3 |
| 5 |
| A、气态氢化物的稳定性:A>B |
| B、B元素的两种同素异形体常温下都是气体 |
| C、最高价氧化物对应水化物的酸性:D>C |
| D、原子半径从大到小的排列顺序为:C>B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、500mL 2mol?L-1 葡萄糖溶液中所含分子数为NA |
| B、0.1mol?L-1Na2CO3溶液中的阴离子总数大于0.1NA |
| C、电解精炼铜时,若阳极质量减少64g,则外电路导线上不一定通过2 NA个电子 |
| D、标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.4 gS6与S8的混合物中所含S原子数一定为0.2 NA |
| B、1 L 0.1 mol.L-1的醋酸溶液中氢离子数为0.1 NA |
| C、以惰性电极电解NaCl溶液时,每放出11.2LCl2时,则消耗NaCl个数为NA |
| D、在密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移的电子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,2.24L氮气含有共用电子对数的0.5NA |
| B、22.4g铁粉完全溶于一定浓度的硝酸中,转移的电子数可能为0.6NA |
| C、4.6g甲醇和二甲醚(CH3-O-CH3)的混合物中所含分子数等于0.1NA |
| D、含Al3+数目为0.1NA的硝酸铝溶液中,NO3-个数大于0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com