
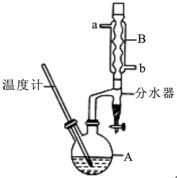
 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:| 相对分子质量 | 沸点/℃ | 密度/(g/cm3) | 水中的溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
分析 (1)步骤①中浓硫酸和正丁醇的添加顺序类似浓硫酸的稀释,注意防止酸液飞溅;
(2)使冷凝管充分冷凝水,进行充分冷却;
(3)用水可以溶解浓硫酸;正丁醇、正丁醚不溶于水,溶液分层,粗产品的密度小于水在上层;
(4)有机层中会残留NaOH及中和反应生成的盐Na2SO4,用水溶解除去;
(5)正丁醚沸点为142℃,粗产品中含有正丁醇,其沸点为117.2℃,低于正丁醚的沸点,加热蒸馏正丁醇先汽化;
(6)反应控制温度135℃,高于正丁醇的沸点,正丁醇、水均挥发,从球形冷凝管中冷凝回流的为正丁醇、水,正丁醇微溶于水,在分水器中会分层,密度小的在上层;
(7)根据正丁醇的质量计算正丁醚的理论产量,样品产率=(实际产量÷理论产量)×100%.
解答 解:(1)因为浓硫酸的密度大,应将浓硫酸加到正丁醇中,防止发生迸溅,
故答案为:正丁醇;
(2)采取逆流原理通入冷凝水,使冷凝管充分冷凝水,进行充分冷却,即从b口通入冷凝水,
故答案为:b;
(3)在反应混合物中,浓硫酸能溶解于水,正丁醚不溶,正丁醇微溶于水,所以步骤③的目的是初步洗去浓硫酸;分液漏斗中振荡静置后,上层液体中为密度比水小的正丁醚和正丁醇,从分液漏斗的上口倒出,
故答案为:浓H2SO4;上;
(4)步骤④中最后一次水洗,可以洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4,
故答案为:洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4;
(5)正丁醚沸点为142℃,粗产品中含有正丁醇,其沸点为117.2℃,低于正丁醚的沸点,加热蒸馏正丁醇先汽化,加热蒸馏时应收集142℃左右的馏分,
故答案为:D;
(6)反应控制温度135℃,高于正丁醇的沸点,正丁醇、水均挥发,从球形冷凝管中冷凝回流的为正丁醇、水,正丁醇微溶于水,密度小于水,在分水器中会分层,正丁醇在上层,水在下层,
故答案为:正丁醇;水;
(7)由2CH3CH2CH2CH2OH  CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,可知37g正丁醇完全反应得到正丁醚的质量为$\frac{37g}{74g/mol}$×$\frac{1}{2}$×130g/mol=32.5g,故样品产率为(11g÷32.5g)×100%=34%,
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,可知37g正丁醇完全反应得到正丁醚的质量为$\frac{37g}{74g/mol}$×$\frac{1}{2}$×130g/mol=32.5g,故样品产率为(11g÷32.5g)×100%=34%,
故答案为:34%.
点评 本题考查有机物的制备实验,为高考常见题型和高频考点,侧重考查物质分离提纯、对原理与操作的分析评价、产率计算等,题目偏重于关注基础考查,中等难度.


科目:高中化学 来源: 题型:选择题
| A. | 目前,工业上冶炼铝通常采用的方法是铝热反应法 | |
| B. | 铝能用于冶炼难熔的金属(如Cr、V、Mn等),这是因为铝具有还原性,在冶炼反应中放出大量的热量 | |
| C. | 由海水制备无水氯化镁,主要有以下步骤:①加熟石灰;②过滤;③加盐酸;④蒸发结晶;⑤在一定条件下脱水干燥 | |
| D. | 在冶金工业上,Na、Mg、Al、K、Ca、Zn 均不能用常用化学还原剂制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
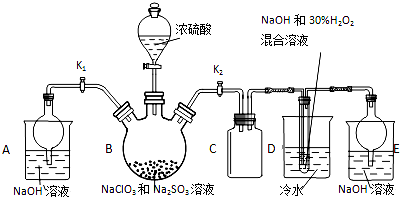 亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答:
亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
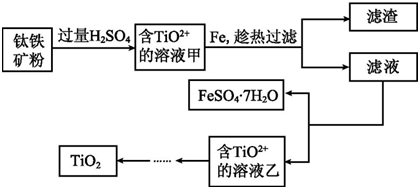
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全氟丙烷(C3F8)与全氟甲烷(CF4)互为同系物 | |
| B. | 石墨能导电,所以石墨属于电解质 | |
| C. | 在化学反应中,原子的种类和数目均保持不变 | |
| D. | 干冰的气化、煤的气化均属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
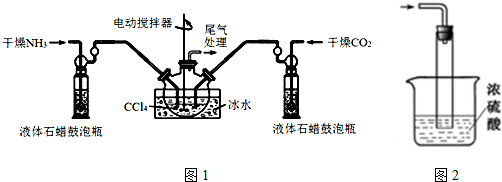
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com