
配制250 mL 0.1 mol/L HCl溶液时,下列操作会使配得溶液的物质的量浓度偏大的是( )
A.定容后摇匀,发现液面低于刻度线,再加水至刻度线
B.转移液体后未洗涤烧杯
C.在容量瓶中进行定容时,俯视刻度线
D.配制前洗涤好的容量瓶内有少量水
科目:高中化学 来源: 题型:
下列对有关实验事实的解释正确的是
A.向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+
B.浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理不相同
C.向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42
D.常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是( )
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+
C.Ca(HCO3)2溶液与少量NaOH溶液反应:
HCO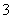 +Ca2++OH-=CaCO3↓+H2O
+Ca2++OH-=CaCO3↓+H2O
D.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
足量的两份铝粉分别与等体积的盐酸和NaOH溶液反应,同温同压下产生的气体体积比为1︰1,则盐酸和NaOH溶液的物质的量浓度之比为( )
A.2︰3 B.3︰1 C.1︰2 D.1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
饮用水中的NO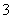 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO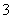 的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO
的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO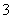 还原为N2,其化学方程式为:Al + NaNO3 + NaOH — NaAlO2 + N2↑+ H2O (未配平)。请回答下列问题:
还原为N2,其化学方程式为:Al + NaNO3 + NaOH — NaAlO2 + N2↑+ H2O (未配平)。请回答下列问题:
(1)上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而________元素的化合价降低,则该元素的原子被________(填“氧化”或“还原”)。
(2)配平上述反应:
Al + NaNO3 + NaOH = NaAlO2 + N2↑+ H2O
(3)用“双线桥法”表示反应中电子转移的方向和数目:
___________________________________________________________。
(4)上述反应中若标准状况下产生11.2 L气体物质,则转移电子的数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究锌与稀硫酸的反应速率[以v(H2)表示],向反应混合液中加入某些物质,下列判断正确的是(双选) ( )。
A.加入NH4HSO4固体,v(H2)不变
B.加入少量水,v(H2)减小
C.加入CH3COONa固体,v(H2)减小
D.滴加少量CuSO4溶液,v(H2)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积不变的密闭容器中存在如下反应:
2SO2(g)+O2(g) 2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是 ( )
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是 ( )
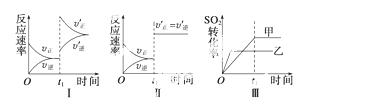
A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有关原子结构及元素周期律的叙述正确的是( )
|
| A. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 |
|
| B. | 同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
|
| C. | 第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
|
| D. | 同主族元素从上到下,单质的熔点逐渐降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com