
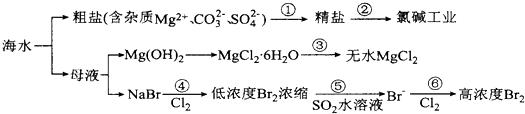
| A. | 过程①的提纯是化学过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 在过程③中将MgCl2•6H2O直接灼烧得不到MgCl2 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br-需消耗2.24LCl2 | |
| D. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
分析 海水蒸发溶剂得到粗盐和母液,粗盐通过精制得到精盐,电解饱和食盐水得到氯气、氢气和氢氧化钠;母液加氢氧化钠反应生成氢氧化镁沉淀,氢氧化镁和酸反应生成氯化镁,制得氯化镁,母液通入氯气氧化溴离子为溴单质,被二氧化硫吸收后发生氧化还原反应生成溴化氢,富集溴元素,通入氯气氧化溴化氢为溴单质得到高浓度的溴.
A.根据粗盐的提纯及电解饱和食盐水产物进行判断;
B.根据镁离子水解及氯化氢的挥发性进行分析;
C.根据物质的量计算氯气气体的体积,必须知道气体摩尔体积;
D.根据反应⑤二氧化硫与溴单质的生成产物进行分析.
解答 解:A.过程①的提纯中过滤属于物理过程,但是除去镁离子、碳酸根离子、硫酸根离子属于化学过程;过程②电解饱和食盐水获得了氯气和氢气两种单质,故A正确;
B.因MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等,直接灼烧得不到MgCl2,若要由MgCl2•6H2O灼烧即可制得无水MgCl2,为防止Mg2+发生水解,应在HCl气氛中进行,故B正确;
C.因2Br-+Cl2 =Br2 +2Cl-,每氧化0.2molBr-需消耗0.1molCl2,0.1molCl2的体积标准状况为2.24L,在其他状况下不一定为2.24L,故C错误;
D.因Br2+SO2 +2H2O=2HBr+H2SO4,反应后溶液呈酸性,能与金属容器反应,故D正确;
故选C.
点评 本题考查了海水资源综合利用,涉及了离子的除杂、离子水解、氧化还原反应、元素及其化合物的有关知识进行综合利用,提高了试题的综合性,本题难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 向未知溶液中加入AgNO3溶液,有白色沉淀产生 | |
| B. | 向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失 | |
| C. | 向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生 | |
| D. | 向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1表示KNO3的溶解度曲线,图中a点表示的溶液通过升温可以得到b点 | |
| B. | 图2表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变 | |
| C. | 图3表示向Na2CO3和NaHCO3的混合溶液中滴加稀盐酸时,产生CO2的情况 | |
| D. | 图4表示向100 mL 0.1 mol/L的AlCl3和0.1 mol/L的NH4Cl混合溶液中滴加1 mol/L的NaOH溶液时n(Al3+)和n(AlO2-)的变化情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金中铜与镁的质量之比是16:3 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L-1 | |
| C. | NO2和N2O4的混合气体中,N2O4的体积分数是80% | |
| D. | 反应中转移电子的物质的量为0.06mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ),下列有关它的说法不正确的( )
),下列有关它的说法不正确的( )| A. | 分子式为C10H16 | |
| B. | 它的一种同分异构体可能是苯的同系物 | |
| C. | 能与溴水发生加成反应 | |
| D. | 属于烃,难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.5mol HCl | B. | 2.5mol H2O | ||
| C. | 108.5g 33.6%的盐酸 | D. | 145g 50.3%的盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com