
【题目】如图是某元素的价类二维图。其中X是一种强碱,G为正盐,通常条件下Z是无色液体,D的相对原子质量比C小16,各物质转化关系如图所示。下列说法正确的是( )
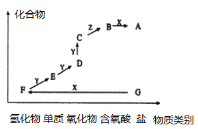
A.D气体一般用排空气法收集B.F和Y在一定条件下不能直接生成C
C.A的水溶液呈酸性D.E→D可用于检验D
【答案】B
【解析】
X是一种强碱,G为正盐,两者反应生成氢化物F,则G为铵盐,F为NH3,F连续与Y反应得到氧化物D与氧化物C,D的相对分子质量比C小16,则Y为O2、E为N2、D为NO、C为NO2,通常条件下Z是无色液体,C与Z反应得到含氧酸B,则Z为H2O、B为HNO3,硝酸与X发生酸碱中和反应得到A为硝酸盐;
A.D为NO,能与空气中氧气反应生成NO2,则不能用排空气法收集NO,应选择排水法收集,故A错误;
B.F为NH3,在纯O2中燃烧生成N2,催化氧化生成NO,不能直接生成NO2,故B正确;
C.A为硝酸与强碱中和反应产物,其水溶液显中性,故C错误;
D.NO的检验是利用NO能与空气中氧气反应生成NO2,气体由无色变为红棕色,即D→C,而不是E→D,故D错误;
故答案为B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-a kJ/mol,则a__238.6(填“>”、“<”或“=”)。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:____。
(3)反应mA(g)+nB(g)![]() pC(g)+qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g)+qD(g)过程中的能量变化如图所示,回答下列问题。
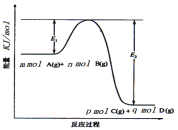
该反应ΔH=___(用含E1、E2式子表示);在反应体系中加入催化剂,E1__,E2__,(填增大、减小、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海军成立68周年时,我国第一艘国产航母成功下水。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢就是抗腐蚀性能强的新型材料。
①基态Ni原子的电子排布式为________________,铬元素在周期表中____区。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4中含有________ mol σ键。
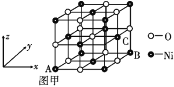
③NiO的晶体结构如图甲所示,其中离子坐标参数 A 为(0,0,0),B为(1,1,0),则C离子坐标参数为____。
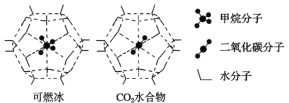
(2)海洋底部有储量丰富的可燃冰,一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
参数 分子 | 分子直径/nm | 分子与H2O的结合能 E/kJ·mol-1 |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中分子间存在的2种作用力是_____________________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知如图中笼状结构的空腔直径为0.586 nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________________________________。
(3)①CH4和CO2所含的三种元素电负性从小到大的顺序为_______________
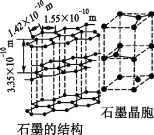
②碳的另一种同素异形体——石墨,其晶体结构如图所示,则石墨晶胞含碳原子个数为____个.已知石墨的密度为ρ g·cm—3,C—C键长为r cm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距为__________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略去)如下:

有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g/cm3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~65℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)仪器D的名称为_____。
(2)①滴加酸性Na2Cr2O7溶液时反应的离子方程式为______________;
②蒸馏不能分离环己酮和水的原因是_____。
(3)环己酮需要经过以下操作提纯:
a.往液体中加入NaCl固体至饱和,静置,分液
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.加入无水MgSO4固体,除去有机物中少量的水
d.过滤
e.蒸馏、除去乙醚后,收集151~156℃馏分
①b中水层用乙醚萃取的目的是_____;
②上述操作a、d中使用的玻璃仪器除烧杯、玻璃棒外,还需要的玻璃仪器有____、___,操作a中,加入NaCl固体的作用是_____。
(4)恢复至室温时,分离得到纯产品体积为8mL,则环己酮的产率为____。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式____________________,已知1mol液态水气化时需要吸收44kJ的热量,则反应![]() 的ΔH为____________________。
的ΔH为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)![]() B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
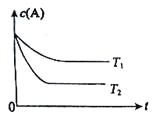
(1)上述反应的温度T1___ T2,平衡常数K(T1)___K(T2)。(填“大于”、“小于” 或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为_______。
②反应的平衡常数K=______。
③反应在0~5min区间的平均反应速率v(A)=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要的工业原材料,现有铜、氧化亚铜组成的混合物,某研究性学习小组为了探究其组成情况,取35.2 g混合物加入0.5 L 3.4 mol·L-1的稀硝酸,固体物质完全反应,生成一氧化氮4.48 L(标准状况)。向所得溶液中加入aL 2.0 mol·L-1氢氧化钠溶液,恰好使溶液中的铜离子沉淀完全。
(1)氧化亚铜与稀硝酸反应的化学方程式为_______________。
(2)混合物中,铜的物质的量为____________;氧化亚铜的物质的量为______________。
(3)所加氢氧化钠溶液的体积是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学课上围绕浓硫酸的化学性质进行如下实验探究,将适量的蔗糖放入烧杯中,加几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。请回答下列问题:
(1)生成的这种黑色物质(单质)是(填化学式)____________________。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的污染物之一,这种刺激性气味气体为(填化学式)_________,反应的化学方程式为________。
(3)根据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有(填字母) _______。
A.酸性 B.吸水性
C.脱水性 D.强氧化性
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液_______,说明这种气体有______性;将(2)中产生的有刺激性气味的气体通入氯水中,发生反应的化学方程式为_______。
(5)能否用澄清石灰水鉴别(2)中产生的两种气体 (填“能”或“不能”)________,若不能,请写出两种可以鉴别这两种气体的试剂:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸(0.1000mol/L)来测定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握_______(填“酸式”或“碱式”)滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________直到加入最后一滴盐酸后,溶液由黄色变为_________色,并_________________________为止。
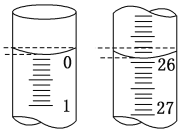
(2)滴定开始和结束时滴定管的液面如图所示,则终点读数为_____mL;所用盐酸体积为_____mL。
(3)对下列几种假设情况进行讨论:(填“偏高”、“偏低”或“无影响”)
①若滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥,则可能使所测NaOH溶液的浓度数值_________;
②若酸式滴定管在滴定前有气泡,滴定后气泡消失,则可能使所测NaOH溶液的浓度数值_______。
(4)有关数据记录如下:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.50 | 25.40 |
第二次 | 20.00 | 0.00 | 25.10 |
根据所给数据,计算出待测NaOH溶液的浓度为__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com