
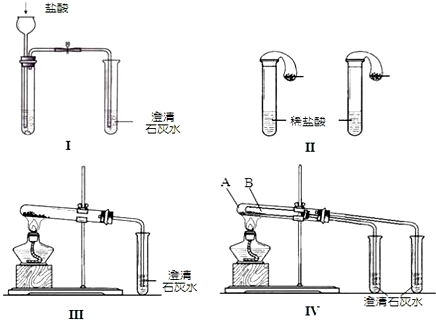
分析 (1)实验Ⅰ中,无论碳酸钠还是碳酸氢钠都能和盐酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊;碳酸钠和盐酸反应分两步进行,盐酸和碳酸钠、碳酸氢钠反应都生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊;
(2)碳酸氢钠不稳定,在加热条件下能分解生成碳酸钠、二氧化碳和水,碳酸钠较稳定,加热不易分解;Ⅳ可以做到用一套装置同时进行两个对比实验,具有较强的对照性;
(3)碳酸氢钠加热易分解,碳酸钠不能,为体现对比,在温度低的试管中盛放碳酸氢钠;
(4)当石灰水过量时,碳酸氢钠完全反应,生成碳酸钙、NaOH和水.
解答 解:(1)Ⅰ装置反应现象相同;Ⅱ装置,向碳酸钠溶液中滴加盐酸先没有气体生成,随着盐酸的不断滴加,后产生气泡,向碳酸氢钠溶液中滴加盐酸立即产生气泡,所以能够达到实验目的是Ⅱ,
故答案为:Ⅱ;
(2)碳酸氢钠在加热条件下能分解生成碳酸钠、水和二氧化碳,发生反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,生成的二氧化碳与澄清石灰水反应生成碳酸钙,反应的方程式为CO2+Ca(OH)2=CaCO3↓+H2O,图Ⅳ不仅能鉴别碳酸钠和碳酸氢钠,同时又能验证碳酸钠和碳酸氢钠的稳定性,Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行,则实验IV的优点是D,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑、CO2+Ca(OH)2═CaCO3↓+H2O;D;
(3)碳酸氢钠加热易分解,碳酸钠不能,为体现对比,在温度低的试管中盛放碳酸氢钠,即用实验IV验证碳酸钠和碳酸氢钠的稳定性,试管B中装入的固体是NaHCO3,
故答案为:NaHCO3;
(4)当石灰水过量时,碳酸氢钠完全反应,生成碳酸钙、NaOH和水,离子反应为Ca2++OH-+HCO3-═CaCO3↓+H2O,故答案为:Ca2++OH-+HCO3-═CaCO3↓+H2O.
点评 本题考查物质的性质实验,为高频考点,把握物质的性质、发生的反应、实验装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥⑦ | B. | ③④⑤⑥⑦ | C. | ①②③⑤⑦⑥ | D. | ①③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
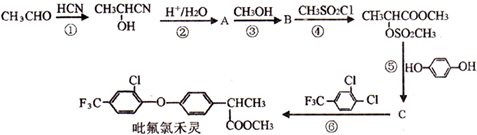
 .
. .
. 制备高分子化合物
制备高分子化合物  的合成路线流程图(无机试剂任选),合成流程示意图如下:CH3CH2$→_{170℃}^{H_{2}SO_{4}}$CH2$→_{催化剂△}^{H_{2}}$CH3CH3.
的合成路线流程图(无机试剂任选),合成流程示意图如下:CH3CH2$→_{170℃}^{H_{2}SO_{4}}$CH2$→_{催化剂△}^{H_{2}}$CH3CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L水中含有1 mol NaCl | |
| B. | 溶液中含有1 mol NaCl | |
| C. | 1 L溶液中含有1 molNaCl | |
| D. | 将58.5 g NaCl溶于1 L水中所得的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡晶体和氯化铵晶体的反应 | |
| B. |  能量变化如图所示的反应 | |
| C. | 燃烧反应和中和反应 | |
| D. | 化学键断裂吸收的热量比化学键生成放出的热量多的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com