
| A. |  转移溶液 | B. | 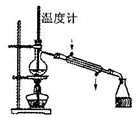 制蒸馏水 制蒸馏水 | C. | 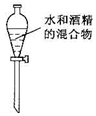 分离水喝酒精 | D. | 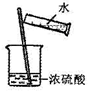 稀释浓硫酸 |
分析 A.转移溶液时用玻璃杯引流,玻璃杯下端放在容量瓶刻度线下方;
B.冷凝管的通水方向错误,应该自下而上通水;
C.水和酒精互溶,不能用分液法分离;
D.稀释浓硫酸时,应该将浓硫酸缓缓加入水中,顺序不能颠倒.
解答 解:A.配制一定浓度的溶液时,转移溶液需要用玻璃杯引流,玻璃杯下端放在容量瓶刻度线下方,图示操作合理,故A正确;
B.制取蒸馏水时,冷凝管应该采用逆向通水,冷凝效果更好,图示操作不合理,故B错误;
C.酒精与水相互溶解,无法通过分液操作分离,故C错误;
D.稀硫酸密度大于水,且稀释时放出大量热,应该将浓硫酸加入水中,故D错误;
故选A.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及配制一定物质的量浓度的溶液、蒸馏、萃取与分液、浓硫酸的稀释等知识,明确常见化学实验基本操作方法为解答关键,试题培养了学生的化学实验能力.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 说法1 | 说法2 | 判断 |
| A | Na+、Mg2+、O2-、F-中离子半径最大的是O2- | I的原子半径大于Br,HI比HBr的热稳定性强 | 说法1说法2均正确 |
| B | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | 热稳定性:HCl>HI | 说法1说法2均正确 |
| C | 原子半径:Na>Mg | 酸性:H2SO3>H2SO4 | 说法1说法2均错误 |
| D | 同主族元素的简单阴离子还原性越强,水解程度越大 | 同周期金属元素的化合价越高,其原子失电子能力越强 | 说法1错误说法2正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 220 | 330 | 440 | 550 | 660 | 770 | 880 |
| 铜平均溶解速率(×10-3mol•L-1•min-1) | 77.34 | 88.01 | 99.25 | 77.98 | 77.24 | 66.73 | 55.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
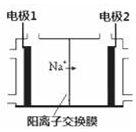 电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”.在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.其中图2是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息,通电以后,Na+向右侧移动,可判断出电极2 是阴极,在该电极周围的溶液中,NaOH浓度将会变大(填“变大”或“减小”或“不变”);电极1上的电极反应式为2Cl--2e-=Cl2↑.
电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”.在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.其中图2是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息,通电以后,Na+向右侧移动,可判断出电极2 是阴极,在该电极周围的溶液中,NaOH浓度将会变大(填“变大”或“减小”或“不变”);电极1上的电极反应式为2Cl--2e-=Cl2↑.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第一电离能:Y一定小于X | |
| B. | 气态氢化物的稳定性:HmY小于HnX | |
| C. | 最高价含氧酸的酸性:X对应的酸性强于Y对应的 | |
| D. | X和Y形成化合物时,X显负价,Y显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com