
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1 mol 的![]() 中,含有0.6NA个中子
中,含有0.6NA个中子
B. 7.1g Cl2通入足量的NaOH溶液中,反应转移电子的数目为0.3NA
C. 标准状况下,1.12L 的SO2所含的原子数目为0.2NA
D. 将足量的MnO2与含HCl 4 mol的浓盐酸混合后充分加热,生成的气体分子数目为NA
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】目前人们对环境保护、新能源开发很重视.
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.4CO(g)+2NO2(g)4CO2(g)+N2(g)△H=﹣1200 kJmol﹣1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是(填代号). 
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/mol.L﹣1/时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0~20min的平均反应速率v(CO2)=;计算该反应的平衡常数K= .
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是(填字母代号).
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率(填“升高”或“降低”),△H0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=﹣159.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式 .
(4)一种氨燃料电池,使用的电解质溶液是2mol/L﹣1的KOH溶液.
电池反应为:4NH3+3O2=2N2+6H2O;
请写出通入a气体一极的电极反应式为;每消耗3.4g NH3转移电子的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)容量瓶不能用于(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.用来加热溶解固体溶质
(2)根据计算用托盘天平称取NaOH的质量为g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度0.1mol/L(填“大于”“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度0.1mol/L.
(3)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL(计算结果保留一位小数)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 . 在配制过程中,下列操作中,能引起误差偏高的有(填代号).
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
②定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
③定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
④定容时,俯视刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。
请填写下列空白:
[实验一]用如图所示装置,收集一试管甲烷和氯气的混合气体,光照后观察到,量筒内形成一段水柱,认为有氯化氢生成。
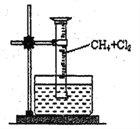
(1)该反应的反应类型为_____________________。
(2)该反应的化学方程式为(只写第一步)______________。
(3)水槽中盛放的液体应为_______。(填标号)
A.水 B.饱和石灰水 C.饱和食盐水 D.饱和NaHCO3溶液
(4)该实验的实验现象为:____________、_____________、试管壁上出现油状液滴
(5)该油状液滴中含有的有机产物共有_______种。
[实验二]收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO3溶液,看到有白色沉锭生成,认为有氯化氢生成。
(6)你认为该实验设计得出的结论是否正确的______,若不正确,理由是:_________________。
[实验三]步骤一:收集半试管氯气,加入10mL蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同),测得pH=3.26
步骤二:收集一试管甲垸和氯气的混合气体(各占50%),在40W的日光灯下光照6min后,加入l0mL蒸馏水,充分振荡,测得pH=1.00。
(7)判断该反应中有氯化氢生成的依据是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 反应中,被氧化的物质是氧化剂
B. 氧化还原反应的本质是电子的转移
C. 某物质的元素在反应中失去电子,则此物质是氧化剂
D. 离子反应可能是复分解反应,但离子反应一定不是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
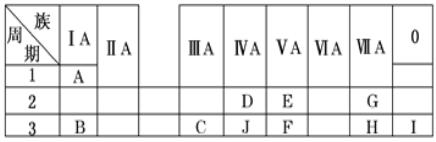
(1)表中元素,化学性质最不活泼的是________,只有负价而无正价的元素是________。(填元素符号)
(2)最高价氧化物的水化物酸性最强的是________,呈两性的是________。
(3)在B、C、E、F中,原子半径最大的是________。
(4)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式:________。
(5)与C元素同族的第5周期元素X的价电子排布式________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用如图装置制取高纯度的苯甲酸甲酯. 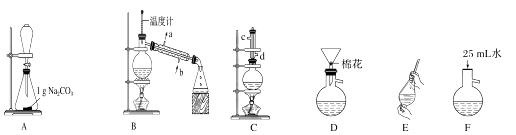
熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 水溶性 | |
苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
甲醇 | ﹣97 | 64.3 | 0.79 | 互溶 |
苯甲酸甲酯 | ﹣12.3 | 199.6 | 1.09 | 不溶 |
有关数据如表所示,请回答下列问题:
(1)在烧瓶中混合有机物及浓硫酸的方法是 , 装置C如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 .
(2)B装置的冷凝管的主要作用是 , 可否换为球形冷凝管(填“可”或“否”).
(3)制备和提纯苯甲酸甲酯的操作先后顺序为(填装置字母代号).
(4)A中Na2CO3的作用是;D装置的作用是
(5)在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号). a.直接将苯甲酸甲酯从分液漏斗的上口倒出
b.直接将苯甲酸甲酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从下口放出
d.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从上口倒出.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L空气中O2、N2分子总数目为NA
B.0.1 mol羟基中所含电子数目为NA
C.28 g乙烯、丙烯混合气体中所含原子数为6NA
D.5.6 g铁与硝酸完全反应时转移的电子数目为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com