
【题目】吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体内的活性氧,由此判断Na2SeO3的作用是
A.作还原剂B.作氧化剂
C.既作氧化剂又作还原剂D.作催化剂
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A. NA的单位是摩尔
B. 12g12C中所含的碳原子数为NA
C. 标况下22.4L的任何气体所含原子数为NA个
D. 相同体积的O2(g)和NO2(g)分子数均为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列关于溶液中微粒的物质的量浓度关系的描述,不正确的是
A. 0.1mol·L-1HCl溶液与0.2mol·L-1NH3·H2O溶液等体积混合pH>7:c(NH3·H2O)>c(Cl-)> c(NH4+)> c(OH-)
B. pH=8的 NaClO2溶液中:c(Na+)>c(ClO2-)>c(OH-)>c(H+)
C. 向氨水中不断通入CO2,随着CO2的增加,![]() 不断减小
不断减小
D. CH3COOH与NaOH溶液发生中和反应,当醋酸过量时,溶液中可能存在:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、 B、 C、 D、 E、 F 为前四周期元素且原子序数依次增大,其中基态 A 原子的电子分布在 3 个能级,且每个能级所含的电子数相同; C 的原子核外最外层有 6 个运动状态不同的电子; D 是短周期元素中电负性最小的元素; E 的最高价氧化物的水化物酸性最强; 基态 F 原子核外最外层只有一个电子, 其余能层均充满电子。 G 元素与 D 元素同主族,且相差 3 个周期。
(1)元素 A、 B、 C 的第一电离能由小到大的是____________________(用元素符号表示)。
(2)E的最高价含氧酸中 E 原子的杂化方式为_____________。 基态 E 原子中,核外电子占据最高能级的电子云轮廓形状为____________________________。
(3)F原子的外围电子排布式为_______________________, F 单质晶体中原子的堆积方式是下图中的_______(填写“甲”、 “乙”或“丙”) ,该晶体的空间利用率为_____________。(保留两位有效数字)

(4)已知元素 A、B形成的(AB)2分子中所有原子都满足 8电子稳定结构,则其分子中 σ键与 π键数目之比为__________。
(5)通常情况下, D 单质的熔沸点比 G 单质高,原因是_________________________。
(6)已知 DE 晶体的晶胞如下图所示:

若将 DE 晶胞中的所有 E 离子去掉,并将 D 离子全部换为 A 原子,再在其中的 4 个“小立方体”中心各放置一个A 原子,且这 4 个“小立方体”不相邻。位于“小立方体”中的 A 原子与最近的 4 个 A 原子以单键相连,由此表示 A的一种晶体的晶胞(已知 A—A 键的键长为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_________个 A 原子,该晶体的密度是______________g·cm-3(列式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到固体TiO2。实验室用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为_________________________________。
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________________。
(3)NH4Fe(SO4)2标准溶液盛装在___________(填“酸式”或“碱式”)滴定管中,滴定终点的现象是________________________。若在滴定终点读取滴定管刻度时,仰视标准液液面使测定结果________(填“偏高”“偏低”或“无影响”)。
(4)滴定分析时,称取TiO2(摩尔质量为Mg·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数表达式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述中错误的是
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池的电极材料不一定参与电极反应
C.在原电池中,电子流出的一极是负极,发生氧化反应
D.原电池放电时,电流的方向是从正极到负极
查看答案和解析>>
科目:高中化学 来源: 题型:
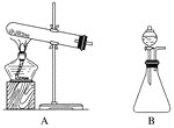
【题目】实验室可用下列几组试剂制取少量NH3:
①固体Ca(OH)2和NH4Cl;②浓氨水和固体CaO;③浓氨水。
请回答下列问题:
(1)用上述三组试剂制取少量NH3,需要加热的是________(填序号),第①组试剂中产生NH3的化学方程式可表示为____________________________________。
(2)下面的制取装置图中,方法①应选用装置________(填“A”或“B”,下同),方法②应选用装置________。
(3)在制取后,如果要干燥氨气,应选用的干燥剂是________(填字母)。
A.浓硫酸 B.固体氢氧化钠 C.五氧化二磷
D.碱石灰 E.固体CaO F.无水CaCl2
(4)检验集气瓶中是否收集满氨气的方法是__________________________________。
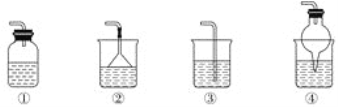
(5)为防止环境污染,如下装置(盛放的液体为水)可用于吸收多余NH3的是________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对反应类型的判断不正确的是
A. CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H20 氧化反应
CH3COONH4+2Ag↓+3NH3+H20 氧化反应
B. ![]() 聚合反应
聚合反应
C. 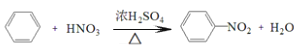 取代反应
取代反应
D. 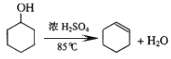 消去反应
消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷是有机合成中的重要原料。实验室制备溴乙烷(C2H5Br,沸点38.4℃)的装置如图所示,其实验步骤为:①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;②向仪器a中加入10mL 95%乙醇、28mL 92%浓硫酸,然后加入适量溴化钠和几粒碎瓷片;③在45~50℃加热2h,使其充分反应。回答下列问题:

(1)仪器a的名称是________。
(2)在大烧杯中加入冰水的目的是________。
(3)加入碎瓷片的作用是________。
(4)为了更好的控制温度,选择常用的加热方式为________。
(5)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为________,生成的无色刺激性气味气体的分子式为________。
(6)U形管内可观察到的现象是_____________。
(7)反应结束后,U形管内粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可以选择下列试剂中的________(填序号)。
A.Na2SO3溶液 B.H2O C.NaOH溶液 D.苯
(8)检验溴乙烷中溴元素的实验步骤是:取少量溴乙烷于试管中,加入NaOH溶液,加热煮沸一段时间,冷却,________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com