
| A、H、Li、Na、K |
| B、I、Br、Cl、F |
| C、Na、Mg、Al、Si |
| D、Si、Al、Mg、Na |


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
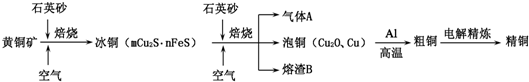
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试剂 | 酚酞试液、CCl4、无水酒精、KSCN溶液 | ||
| 方案 | 操作步骤 | 实验现象 | 结论 |
| 1 | 取所述黄色溶液于试管中,滴加并振荡 | 溶液变红色 | |
| 2 | 取所述黄色溶液于试管中,滴加并振荡 | (同上) | |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
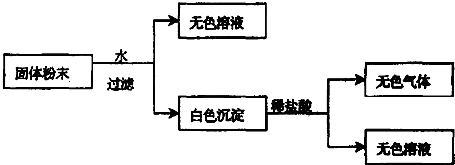
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、40 | B、48 | C、41 | D、49 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
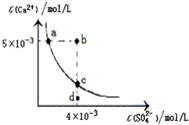
| A、CaSO4在稀硫酸中的溶解性比在纯水中的溶解性 强 |
| B、b点将有沉淀生成,平衡后溶液中c(SO42-)一定等 于3×10-3 mol/L |
| C、d点溶液通过蒸可以变到c点 |
| D、a点对应的Ksp等于c点对应的Ksp |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com