
银锌纽扣电池工作时的反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是( )
|
| A. | 锌是阴极,Ag2O是阳极 |
|
| B. | 电解质溶液为碱溶液,不可能是强酸溶液 |
|
| C. | 锌电极的反应式为:Zn+2OH﹣﹣2e﹣=Zn(OH)2 |
|
| D. | 若工作时转移电子0.2mol,则消耗Zn的质量为6.5g |
| 原电池和电解池的工作原理. | |
| 专题: | 电化学专题. |
| 分析: | 原电池Zn+Ag2O+H2O=Zn(OH)2+2Ag中,负极反应为Zn+2OH﹣﹣2e﹣=Zn(OH)2、正极反应为Ag2O+H2O+2e﹣=2Ag+2OH﹣,电子由负极流向正极,以此来解答. |
| 解答: | 解:A、原电池中Zn做负极,发生氧化反应,为阳极,故A错误; B、电解质溶液为酸性时,能够与锌反应,故B正确; C、原电池Zn+Ag2O+H2O=Zn(OH)2+2Ag中,负极反应为Zn+2OH﹣﹣2e﹣=Zn(OH)2,故C正确; D、Zn由0价变为+2价,转移电子0.2mol,则消耗Zn的质量为6.5g,故D正确; 故选A. |
| 点评: | 本题考查原电池知识,题目难度不大,明确电极反应、原电池的正负极以及电池反应的关系,注意结合氧化还原反应来分析. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
有下列几组物质,请将序号填入下列空格内:
①CH2=CH﹣COOH和油酸(C17H33COOH) ②12C60和石墨 ③35Cl和37Cl ④乙醇和乙二醇
⑤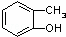 和
和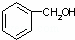 ⑥
⑥ 和
和
(1)互为同位素的是 ;
(2)互为同系物的是 ;
(3)互为同素异形体的是 ;
(4)互为同分异构体的是 ;
(5)既不是同系物,又不是同分异构体,但可看成是同一类物质的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示进行实验,下列说法正确的是( )
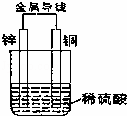
|
| A. | 铜片上冒气泡,该气体是H2,铜片是正极,该装置是原电池 |
|
| B. | 锌片质量减小,锌片是负极,发生还原反应 |
|
| C. | 电子流向:锌→导线→铜→稀硫酸→锌,形成一个闭合回路 |
|
| D. | 溶液中的阳离子移向负极,阴离子移向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于1﹣20号元素的原子结构的有关说法正确的( )
|
| A. | 离子的最外层电子数比其次外层电子数多的元素一定是第二周期的元素 |
|
| B. | 元素形成的简单离子中,最外层电子数一定是8或2 |
|
| C. | 最外层电子数与次外层电子数相等的离子一定是第三周期的非金属元素 |
|
| D. | 原子得到电子成为阴离子时,电子层数一定不变,原子失去电子成为阳离子时,电子层数一定减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两容器中均进行反应:N2+3H2⇌2NH3,在相同时间内,甲容器中断裂1molN≡N键且同时形成3molH﹣H键,乙容器中断裂0.5molN≡N键且同时断裂3molN﹣H键,下列说法正确的是( )
|
| A. | 甲容器中的反应速率一定大于乙容器中的反应速率 |
|
| B. | 甲容器中的反应速率可能小于乙容器中的反应速率 |
|
| C. | 无法判断两容器中的上述反应是否都达到了平衡状态 |
|
| D. | 上述两容器中的反应一定是在相同温度和相同压强下进行的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.实验室常见的几种气体发生装置如图A、B、C所示:
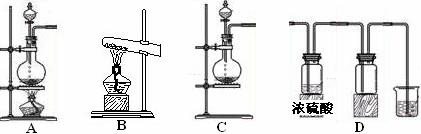
(1) 实验室可以用B或C装置制取氨气,如果用B装置制取氨气其化学反应方程式为
。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是
_____________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可以是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2 ⑤HCl
其中在D装置中连接小烧杯的目的是 。
Ⅱ.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
(4)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3 ,钴的化合价为________,制备X的化学方程式为
已知:X的化学式类似下列化学式
氢氧化二氨合银:Ag(NH3)2OH 、硫酸四氨合铜:Cu(NH3)4SO4
(5)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1 的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
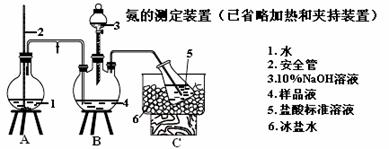
①盛放5(盐酸标准溶液)的仪器名称
②装置中安全管的作用原理是
③样品中氨的质量分数表达式为
查看答案和解析>>
科目:高中化学 来源: 题型:
配制一定物质的量浓度的KOH溶液时,造成最终浓度偏低的原因可能是( )
|
| A. | 容量瓶事先未烘干 |
|
| B. | 定容时俯视观察液面 |
|
| C. | 未用蒸馏水洗涤烧杯 |
|
| D. | 定容后,摇匀时有少量液体流出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com