
| A. | 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 定容后,塞好瓶塞,反复倒转、摇匀 | |
| C. | 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解 |
分析 A、容量瓶不能作为溶解仪器;
B、根据配制溶液的实验步骤来回答;
C、移液操作需要玻璃棒来引流;
D、称取10.6 g无水碳酸钠,加入100 mL蒸馏水,则溶液体积大于100mL.
解答 解:A、容量瓶不能作为溶解仪器,称量固体后不能在容量瓶中溶解,应先在烧杯中溶解,故A错误;
B、定容后,塞好瓶塞,要进行摇匀操作,故B正确;
C、移液操作时,防止液体外溅,需要玻璃棒来引流,故C错误;
D、称取10.6 g无水碳酸钠,加入100 mL蒸馏水,则溶液体积大于100mL,则溶液浓度将小于1.0mol/L,故D错误.
故选B.
点评 本题考查了一定物质的量浓度溶液的配制过程中的操作正误和误差分析,属于基础型题目,难度不大.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
 其含有的共价键类型是极性共价键.
其含有的共价键类型是极性共价键.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
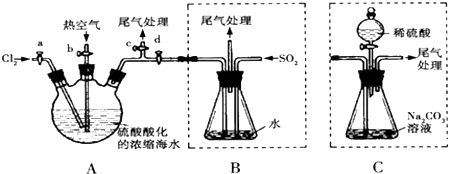
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度实验次数 | 起始温度t2 /℃ | 终止温度 t2 /℃ | 温度差平均值 (t2- t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL0.1 mol•L-1氨水与10 mL0.1 mol•L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL0.1 mol•L-1NH4Cl溶液与5 mL0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL0.1 mol•L-1CH3COOH溶液与5 mL0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
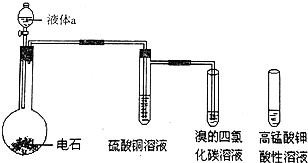 如图是实验室制取乙炔气体及乙炔的性质实验的装置,气密性已检验,部分夹持装置略.
如图是实验室制取乙炔气体及乙炔的性质实验的装置,气密性已检验,部分夹持装置略. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
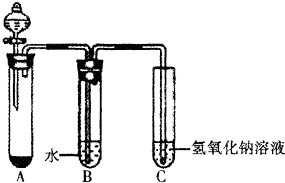 某课外小组同学用下图所示装置进行C12的制备及相关性质实验(加热及夹持装置已省略).
某课外小组同学用下图所示装置进行C12的制备及相关性质实验(加热及夹持装置已省略).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com