
| A、氨水中通入过量CO2:2NH3?H2O+CO2═2NH4++CO32-+H2O |
| B、稀硝酸中加入过量铁粉:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
| C、钠与水反应Na+2H2O═Na++2OH-+H2↑ |
| D、Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O═HClO+HSO3- |


科目:高中化学 来源: 题型:
| A、钠与氧气在常温下反应生成氧化钠 |
| B、将钠置于干燥的氧气中充分反应,可能有过氧化钠生成 |
| C、钠易与氧气反应,但不能跟其他非金属反应 |
| D、将钠置于空气中一段时间,可能有碳酸钠生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向正反应方向移动了 |
| B、平衡向逆反应方向移动了 |
| C、物质B的质量分数减小了 |
| D、a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水、浓硫酸 |
| B、KMnO4酸性溶液、浓硫酸 |
| C、溴水、浓硫酸 |
| D、浓硫酸、KMnO4酸性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素R位于周期表中第ⅤA族 |
| B、RO3-中的R只能被还原 |
| C、CaR2是离子化合物,阴阳离子电子层结构相同,且既含有离子键,又含有共价键 |
| D、3 mol R2中,氧化产物与还原产物的质量比为5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
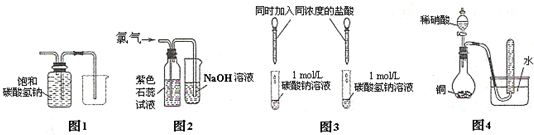
| A、①② | B、②④ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d亚层为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d亚层为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com