
| A. | 工业上常用MnO2和稀盐酸共热来制取氯气 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 在氧化还原反应中,Cl2只能作氧化剂 | |
| D. | 若含0.4 mol HCl的浓盐酸,MnO2过量,可制得标准状况下氯气2.24 L |
分析 A.MnO2和稀盐酸共热不能生成氯气,工业制备是电解饱和食盐水;
B.新制氯水中氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白作用,盐酸具有酸性;
C.氯气和水的反应是自身氧化还原反应,氯气和金属发生的反应中氯气只做氧化剂;
D.若含0.4 mol HCl的浓盐酸,MnO2过量,随反应进行浓盐酸变化为稀盐酸不能和二氧化锰反应生成氯气;
解答 解:A.MnO2和稀盐酸共热不能生成氯气,工业制备是电解饱和食盐水得到,2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,故A错误;
B.新制氯水中氯气和水反应生成盐酸和次氯酸,Cl2+H2O?HCl+HClO,盐酸具有酸性使蓝色石蕊试纸变红,次氯酸具有漂白性,蓝色石蕊试纸先变红后褪色,故B正确;
C.氯气和水的反应是自身氧化还原反应,氯气是氧化剂和还原剂,氯气和铁反应中氯气做氧化剂,故C错误;
D.若含0.4 mol HCl的浓盐酸,MnO2过量,随反应进行浓盐酸变化为稀盐酸不能和二氧化锰反应生成氯气,可制得标准状况下氯气小于2.24 L,故D错误;
故选B;
点评 本题考查了氯气的性质、氧化还原反应实质分析,注意浓盐酸反应随浓度减小变为稀盐酸后不能反应生成氯气,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 少量SO2通入CaCl2溶液能生成白色沉淀 | |
| B. | 可以用澄清石灰水鉴别SO2和CO2 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| D. | SO2能使FeCl3、KMnO4水溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 构成原电池时,电子流动方向是:从铁片流出,经过溶液,流到铜片,再回流到铁片,形成电流 | |
| B. | 构成原电池时溶液中SO42-离子移向Cu片 | |
| C. | 要使Fe片不被腐蚀,可将铜片换成锌片或将铁片直接接直流电源正极 | |
| D. | 要在铁片上镀一层薄薄的铜,在Cu片上反应为:Cu-2e→Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性X>Y | |
| B. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| C. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| D. | 一定条件下,W单质不能将Z单质从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上反应均可发生 | B. | 只有①不能发生 | ||
| C. | 只有③不能发生 | D. | 只有④不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
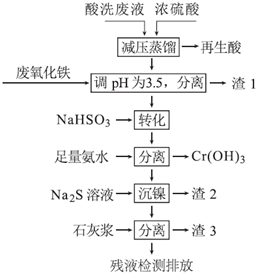
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl元素的相对原子质量为37 | |
| B. | $\frac{1}{20}$mol的1H37Cl分子所含中子数约为6.02×1023 | |
| C. | 7.4 g的37Cl2气体的体积为2.24L | |
| D. | 37Cl2气体的摩尔质量为74g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | O-O | O=O | C-0 | C=O | H-O |
| 能量(KJ) | 415 | 138 | 498 | 343 | 798 | 465 |
| A. | 放出热量800kJ | B. | 放出热量1520kJ | C. | 吸收热量410kJ | D. | 放出热量610kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com