
| A、通过蓝色石蕊试液 |
| B、通过品红溶液 |
| C、通过澄清的石灰水 |
| D、先通过过量的酸性KMnO4溶液,再通过澄清的石灰水 |


科目:高中化学 来源: 题型:
| A、X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 |
| B、Y的氢化物比R的氢化物稳定,Y的氢化物比R的氢化物熔沸点低 |
| C、Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z |
| D、Y分别与Z、W、R以两种元素组成的常见化合物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两溶液中的离子总数相等 |
| B、两溶液中的c(Na+)、c(H+)分别相等 |
| C、c(Na+)=c(CN-)+c(HCN) |
| D、NaF溶液中的离子总数较少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,6.4g S6与S8的混合物中所含S原子数为0.2NA |
| B、1L 1mol/L FeCl3溶液中Cl-数为NA |
| C、标况下,2.24LH2O所含原子数为0.3NA |
| D、22g二氧化碳与标况下11.2L HCl含有的分子数均为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
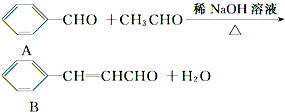
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
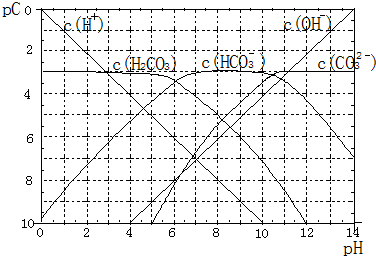
查看答案和解析>>
科目:高中化学 来源: 题型:
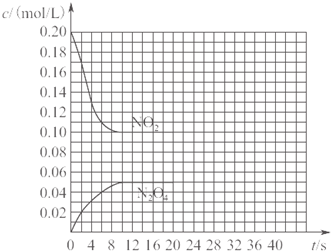 在30℃时,将0.40mol的二氧化氮气体充入2L抽空的密闭容器中,经过10s达到平衡,浓度变化曲线如图所示.
在30℃时,将0.40mol的二氧化氮气体充入2L抽空的密闭容器中,经过10s达到平衡,浓度变化曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com