
化学——选修2:化学与技术]
双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:

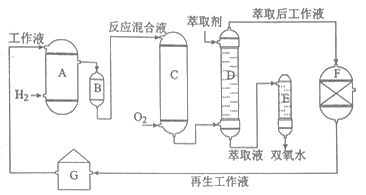
A氢化釜 B过滤器 C氧化塔 D萃取塔
E净化塔 F工作液再生装置 G工作液配制装置
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是___________,循环使用的原料是__________,配制工作液时采用有机溶剂而不采用水的原因是__________。
(2)氢化釜A中反应的化学方程式为___________,进入氧化塔C的反应混合液中的主要溶质为___________
(3)萃取塔D中的萃取剂是________,选择其作萃取剂的原因是______________。
(4)工作液再生装置F中要除净残留的H2O2,原因是______________。
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为___ _____一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为__ ____mol/L。
科目:高中化学 来源:2017届广西省高三上9月月考化学试卷(解析版) 题型:选择题
下列实验操作能达到实验目的的是
实验目的 | 实验操作 | |
A | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和的FeCl3溶液中 |
B | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
C | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
D | 比较水与乙醇中氢的活泼性 | 分别将少量钠投入到盛有水和乙醇的烧杯中 |
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
如图是元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是

A. 气态氢化物的稳定性:W>R
B. 元素T的最高价氧化物水化物可能是强碱
C. Q的原子半径比T小
D. W和Q的原子序数相差10
查看答案和解析>>
科目:高中化学 来源:2017届西藏自治区拉萨中学高三上第一次月考化学卷(解析版) 题型:实验题
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅰ.摩擦剂中氢氧化铝的定性检验:
取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是 。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是 。
Ⅱ.牙膏样品中碳酸钙的定量测定:
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
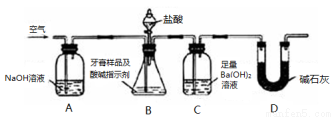
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有: 。
(4)C中反应生成BaCO3的化学方程式是 。
(5)下列各项措施中,不能提高测定准确度的是 (填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g,则样品中碳酸钙的质量分数为 。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是 。
查看答案和解析>>
科目:高中化学 来源:2017届西藏自治区拉萨中学高三上第一次月考化学卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列叙述正确的是
A.等物质的量的N2和CO所含分子数均为NA
B.1.7g H2O2中含有的电子数为0.9NA
C.1mol Na2O2固体中含离子总数为4N A
A
D.标准状况下,2.24L戊烷所含分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
用已知浓度的NaOH标准液滴定未知浓度的醋酸溶液,下列操作会导致测定结果偏高的是:
A.以甲基橙为指示剂滴至溶液由红色变橙色
B.滴定前碱式滴定管尖嘴处有气泡,滴定后气泡消失
C.读滴定管读数时,滴定前仰视,终点时俯视
D.振荡时锥形瓶中的液滴溅出来
查看答案和解析>>
科目:高中化学 来源:2017届陕西省西安市高三上学期10月月考化学试卷(解析版) 题型:实验题
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验:

主要步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的重量,得到b g
④从分液漏斗滴入6mol·1-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓慢鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的重量,得到c g
⑦ 重复步骤⑤和⑥的操作一直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏高、偏低或不变)
(4)步骤⑤的目的是
(5)步骤⑦的目的是
(6)该试样中纯碱的质量分数的计算式为
(7)还可以用其他实验方法测定试样中纯碱的质量分数,请简述一种不同的实验方法
查看答案和解析>>
科目:高中化学 来源:2017届陕西省西安市高三上学期10月月考化学试卷(解析版) 题型:选择题
NaH是—种离子化合物,它跟水反应的方程式为:NaH+H2O→NaOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是( )
A.跟水反应时,水作氧化剂 B.NaH在水中显酸性
C.跟液氨反应时,有NaNH2生成 D.跟乙醇反应时,NaH被氧化
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:选择题
把0.6 mol X气体和0.4 mol Y气体混合于2 L容器中使它们发生如下反应,3X(g) + Y(g)  nZ(g) + 2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示反应的平均速率为0.01 mol/(L·min),则上述反应中Z气体的反应方程式中化学计量数n的值是( )
nZ(g) + 2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示反应的平均速率为0.01 mol/(L·min),则上述反应中Z气体的反应方程式中化学计量数n的值是( )
A.1 B.2 C.3 D.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com