
【题目】H2CO3是一种二元弱酸,常温下H2CO3水溶液中碳元素的存在形态的物质的量分数与溶液的pH的关系如图所示,据此分析,下列说法不正确的是( )

A.pH=8时,溶液中含碳元素的微粒主要是HCO3—
B.A点,溶液中H2CO3和HCO3-浓度相同
C.当c(HCO3-)=c(CO32-)时,c(H+)<c(OH-)
D.pH=8.4的水溶液中加入NaOH溶液时,发生反应的离子方程式可为:HCO3-+OH-=CO32-+H2O
【答案】B
【解析】
A. 由图象可知,当pH=8时,溶液中HCO3-物质的量分数最大;
B. A点HCO3-的物质的量分数与CO2的碳酸溶液物质的量分数相同;
C. 当c(HCO3-)=c(CO32-)时,pH=10;
D. pH=8.4的水溶液主要是NaHCO3溶液,加入NaOH溶液时反应生成Na2CO3和水。
A. 由图象可知,当pH=8时,溶液中HCO3-物质的量分数最大,因此溶液中含碳元素的微粒主要是HCO3-,A项正确,不符合题意;
B. A点HCO3-的物质的量分数与CO2的碳酸溶液物质的量分数相同,溶液中H2CO3和HCO3-浓度不同,B项错误,符合题意;
C. 当c(HCO3-)=c(CO32-)时,pH=10,溶液为碱性,c(H+)<c(OH-),C项正确,不符合题意;
D. pH=8.4的水溶液主要是NaHCO3溶液,加入NaOH溶液时反应生成Na2CO3和水,离子方程式为:HCO3-+OH-=CO32-+H2O,D项正确,不符合题意;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源(左池),以Al作阳极、Pb作阴极,电解稀硫酸(右池),使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O ![]() Al2O3+3H2↑。
Al2O3+3H2↑。
关闭K,电解过程中,以下判断正确的是

A. 两池中H+均移向Pb电极
B. 左池每消耗3 mol Pb,右池生成2 mol Al2O3
C. 左池Pb电极质量增加,右池Pb电极质量不变
D. 左池正极反应:PbO2+4H++2e-=Pb2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氨作为燃料的燃料电池,具有能量效率高的特点,另外氨气含氢量高,易液化,方便运输和贮存,是很好的氢源载体。NH3-O2燃料电池的结构如图所示,下列说法正确的是( )
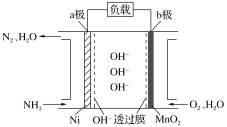
A.a极为电池的正极
B.负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
C.当生成1 mol N2时,电路中通过的电子的物质的量为3 mol
D.外电路的电流方向为从a极流向b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AG=lg![]() ,电离度α=
,电离度α=![]() ×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
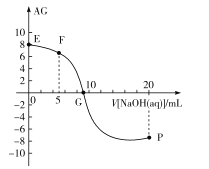
下列说法错误的是( )
A.F点溶液pH<7
B.G点溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
C.V=10时,溶液中c(OH-)<c(HX)
D.常温下,HX的电离度约为1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10.0 mL 0.10 mol/L氨水中滴入0.10 mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出)。下列有关叙述正确的是( )

A. M~N间一定存在:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B. M点对应的盐酸体积为10.0 mL
C. P点处的溶液中存在:2c(NH4+)+2c(NH3·H2O)=c(Cl-)
D. pH=7的溶液中:c(NH4+)=c(Cl-)=c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4KJ/mol,据此回答以下问题:
2NH3(g)△H=-92.4KJ/mol,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)___________。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越__________。
(3)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________________(可用分数表示)。
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是

A. 装置A气密性的检查方法:直接向长颈漏斗中加水,当漏斗中液面高于试管中液面且高度不变说明气密性良好
B. 装置B中盛放硅胶,目的是除去A中挥发出来的少量水蒸气
C. 装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D. 装置A也可直接用于Cu与浓硫酸反应制取SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,完全正确的一组是( )
①用试管夹夹持试管时,将试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过![]() 容积的试管加热
容积的试管加热
③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,再竖立试管
⑤取用放在细口瓶中液体时,取下瓶塞倒放在桌面上,倾倒液体时,瓶上的标签对着地面
⑥配制一定物质的量浓度溶液的容量瓶必须先干燥
⑦用坩埚钳夹取加热后的蒸发皿
⑧将胶头滴管垂直伸进试管内滴加液体
⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑩检验装置的气密性时,把导管一端浸入水中,用手捂住容器的外壁或用酒精灯微热.
A.①④⑦⑩B.①④⑤⑦⑩C.①④⑤⑦⑧⑩D.④⑤⑦⑧⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mo1)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
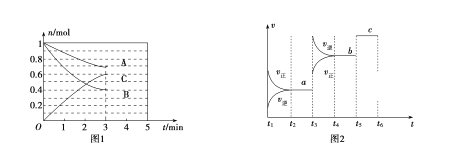
(1)该反应的化学方程式为__________________,此反应平衡常数的表达式为K=________。
(2)从开始到最初达到平衡,C的平均反应速率v(C)=________________。3min时,A的转化率=________%。该反应的![]() ________0。(填“
________0。(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)
”)
(3)对于该反应改变某些条件,化学反应速率及化学平衡状态可能会发生变化,请回答:
①恒温恒容充入惰性气体,平衡______移动(填“正向”、“逆向”或“不”,下同)
②恒温恒压充入惰性气体,平衡______移动,化学反应速率_______(填“加快”或“减慢”)
③升高温度,平衡______移动。
(4)该反应的反应速率v随时间t的关系如图2所示:
①根据图2判断,在t3时刻改变的外界条件是_______,t5时刻改变的外界条件是_______。
②a、b、c三个阶段中,C的体积分数最大的是________,
③a、b、c三个阶段的平衡常数分别用K1、K2、K3表示则:K1、K2、K3 之间的关系为___________(用“![]() ”、“
”、“![]() ”或“
”或“![]() ”连接)。
”连接)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com