
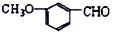
 含有的官能团是醚键、醛基(填名称);它有多种同分异构体,其中属于酯且含有苯环结构的共有6种.
含有的官能团是醚键、醛基(填名称);它有多种同分异构体,其中属于酯且含有苯环结构的共有6种.  阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 编号 | 实验内容 | 实验目的 |
| A | 测定相同物质的量浓度的KOH和氨水的pH | 证明氨水中存在电离平衡 |
| B | 向混有NaCl的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂) | 滴定其中NaOH含量 |
| C | 将Mg、Al和NaOH溶液设计为原电池 | 比较Mg、Al活泼性强弱 |
| D | 用惰性电极电解饱和食盐水,阴极附近滴加酚酞 | 验证阴极有碱生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质广泛用于制作光导纤维 | |
| B. | 液氨可用作制冷剂 | |
| C. | 常温下可用铝制容器盛装浓硫酸 | |
| D. | 明矾常用于水的净化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
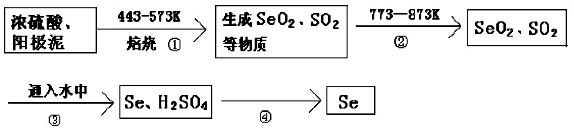
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
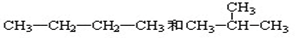

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5的溶液中c(H+)=1.0×10-5 mol•L-1 | |
| B. | pH=7的溶液呈中性 | |
| C. | pH值为0的溶液中c(H+)=0 mol/L | |
| D. | pH=5的溶液中c(OH-)=1.0×10-9 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com