
| A、元素原子的最外层电予数等于元素的最高化合价 |
| B、电子层数相同的主族元素,最外层电子数多的原子半径小 |
| C、K、Mg、Al失电子能力和最高价氧化物水化物的碱性均依次增强 |
| D、第三周期元素中,最外层电子数≥电子层数的为非金属元素 |


科目:高中化学 来源: 题型:
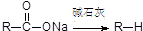 ; ②
; ②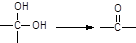 ,有机物A的水溶液显酸性,遇 FeCl3不显色,苯环上的一氯代物只有两种结构.试根据图中各有机物的相互转化关系回答:
,有机物A的水溶液显酸性,遇 FeCl3不显色,苯环上的一氯代物只有两种结构.试根据图中各有机物的相互转化关系回答:
查看答案和解析>>
科目:高中化学 来源: 题型:
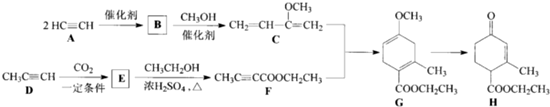
查看答案和解析>>
科目:高中化学 来源: 题型:
 膳食纤维具有突出的保健功能,人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )| A、芥子醇的分子式是C11H14O4,属于芳香烃 |
| B、芥子醇分子中所有碳原子不可能在同一平面 |
| C、芥子醇能与FeCl3溶液发生显色反应,且1mol芥子醇能够与3mol的Br2水反应 |
| D、芥子醇能发生的反应类型有氧化、取代、加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋可同时用作防腐剂和调味剂 |
| B、必须严格控制食品添加剂的用量 |
| C、碘是人体必须的微量元素之一,有智力元素之称 |
| D、人们必须根据自己的口味选择食物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com