
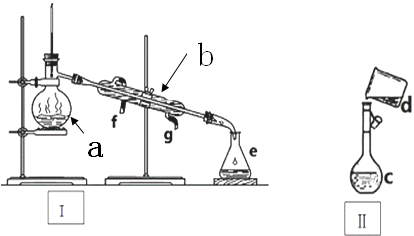
分析 (1)根据仪器的结构特点判断;
(2)有活塞和玻璃塞的仪器使用时必须检查是否漏水;
(3)分离四氯化碳和酒精的混合物必须用酒精灯加热,实质是蒸馏过程,温度计应位于蒸馏烧瓶支管口,冷凝管下口是进水口,上口是出水口;
(4)①根据配制一定物质的量浓度的溶液的方法和操作来寻找装置中的错误,并判断使用仪器;
②根据n=CV和m=nM来计算;
③根据配制一定物质的量浓度的溶液的方法,判断操作步骤;
④根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断,如果n偏大或V偏小,则所配制溶液浓度偏高.
解答 解:(1)a为蒸馏烧瓶,b为冷凝管,c为容量瓶,故答案为:蒸馏烧瓶;冷凝管;容量瓶;
(2)容量瓶在使用前要检查是否漏水,蒸馏烧瓶、冷凝管、烧杯、锥形瓶不需要检查是否漏水,故答案为:c;
(3)分离四氯化碳和酒精的混合物用蒸馏的方法分离,必须用酒精灯,温度计应位于蒸馏烧瓶支管口,冷凝管下口是进水口,上口是出水口,
故答案为:酒精灯;蒸馏烧瓶支管口;g;f;
(4)①配制一定物质的量浓度的溶液是必须用玻璃棒引流,防止液体外溅;配制溶液的操作步骤:首先计算出需要的药品的质量,然后用托盘天平称量,后放入烧杯中溶解,同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃杯引流移液至500ml容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1至2CM时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶.用到的仪器有:分析天平、药匙、烧杯、玻璃棒、500ml容量瓶、胶头滴管,故还需:玻璃棒、钥匙、胶头滴管,
故答案为:未用玻璃棒引流;玻璃棒、胶头滴管;
②由于无450ml容量瓶,故要选用500ml容量瓶,配制出500ml 0.1mol/L的NaOH溶液,所需的NaOH的物质的量n=CV=0.5L×0.1mol/L=0.05mol,质量m=nM=0.05mol×40g/mol=2.0g;
故答案为:2.0;
③根据操作过程是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶可知正确的操作步骤是BCAFED,故答案为:BCAFED;
④A.称量时用了生锈的砝码,则溶质的质量偏大,浓度偏高,故A正确;
B.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,则冷却后,溶液的体积偏小,浓度偏高,故B正确;
C.往容量瓶转移时,有少量液体溅出,液体中含有溶质,则溶质的质量偏小,浓度偏低,故C错误;
D.未洗涤溶解NaOH的烧杯,则溶质的质量偏小,浓度偏低,故D错误;
E.定容时仰视刻度线,溶液的体积偏大,浓度偏低,故E错误;
F.容量瓶未干燥即用来配制溶液,只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故F错误;
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,则溶液的体积偏大,浓度偏低,故G错误;
故选AB.
点评 本题考查了一定物质的量浓度溶液的配制过程中涉及到的仪器的选择、计算、误差分析等问题,难度不大.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ⑤ | C. | ③④⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t(秒) | 0 | 500 | 1000 |
| N2O5浓度mol•L-1 | 5.00 | 3.50 | 2.42 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯元素是生产生活中常见的非金属元素
氯元素是生产生活中常见的非金属元素查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量不是1mol | B. | 含的氧原子个数为1mol | ||
| C. | 质子数是2mol | D. | 氧分子个数为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2为相同元素组成的金属氧化物,都属于碱性氧化物 | |
| B. | SiO2、CO2均为酸性氧化物,均能与NaOH溶液反应生成盐和水 | |
| C. | FeO、Fe2O3均为碱性氧化物,与氢碘酸反应均只发生复分解反应 | |
| D. | 将Fe(OH)3胶体和泥水分别进行过滤,分散质均不能通过滤纸孔隙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸 | B. | 烧碱溶液 | C. | 氢氧化钡溶液 | D. | 氯化钡溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com