
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径/10-10 nm | 0.73 | 1.30 | 1.34 | 1.06 | 0.99 | 1.54 | 0.75 | 1.02 |
| 最高或最低化合价 | -2 | +2 | +1 | +5 | +7 | +1 | -3 | +6 |
| A. | ③和⑤处于同一周期 | |
| B. | 气态氢化物的稳定性④大于⑧ | |
| C. | 上述八种元素最高价氧化物对应的水化物中,⑤的酸性最强 | |
| D. | ①与⑥只能形成一种化合物 |
分析 主族元素中,元素的最高化合价与其族序数相等,最低化合价的绝对值=8-原子的最外层电子数,同一周期中,元素的原子半径随着原子序数的增大而减小,同一主族中,元素的原子半径随着原子序数的增大而增大,根据表中数值知,③⑥为第IA族元素,根据原子半径知,③是Li元素,⑥是Na元素;②是第IIA族元素,④⑦是第VA族元素,⑤是第VIIA族元素,①⑧是第VIA族元素,根据原子半径知,④是P元素、⑦是N元素,①是O元素、⑧是S元素,②是Mg元素,⑤是Cl元素,以此解答该题.
解答 解:由以上分析可知①是O元素、②是Mg元素、③是Li元素、④是P元素,⑤是Cl元素、⑥是Na元素、⑦是N元素、⑧是S元素.
A.③是Li元素,⑤是Cl元素,二者处于不同周期,故A错误;
B.④是P元素、⑧是S元素,元素的非金属性越强,其氢化物越稳定,同一周期中,元素的非金属性随着原子序数的增大而增强,所以气态氢化物的稳定性⑧大于④,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物的酸性越强,上述八种元素最高价氧化物对应的水化物中酸性最强的是HClO4,即⑤的酸性最强,故C正确;
D.①是O元素、⑧是S元素,二者形成的化合物有二氧化硫、三氧化硫,故D错误;
故选C.
点评 本题考查结构性质位置关系应用,为高考常见题型,侧重考查学生的分析能力,关键是根据原子半径及化合价来推断元素,注意对元素周期律的理解,熟悉元素及其单质、化合物的性质.


科目:高中化学 来源: 题型:选择题
| A. | 检验溶液中是否含有 CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水 | |
| B. | 检验溶液中是否含有 NH4+:先滴加浓 NaOH 溶液并加热,再用湿润的红色石 蕊试纸 | |
| C. | 检验溶液中是否含有 Fe2+:先滴加氯水,再滴加 KSCN 溶液 | |
| D. | 检验溶液中是否含有 SO42-:先滴加氯化钡溶液,再滴加稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用溴的四氯化碳溶液可除去甲烷中的乙烯 | |
| B. | 乙烯和苯均能使酸性高锰酸钾溶液褪色 | |
| C. | 苯在空气中燃烧时冒浓烟,说明苯组成中含碳量较高 | |
| D. | 间二甲苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2moL | B. | 0.1moL | ||
| C. | 小于0.1moL | D. | 大于0.1moL,小于0.2moL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀HNO3中:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 将过量的SO2+ClO-+H2O═HClO+HSO3- | |
| D. | 将0.2mol•L-1NH4HCO3溶液与0.3 mol•L-1Ba(OH)2溶液等体积混合:HCO3-+NH4++Ba2++2OH-═NH3•H2O+H2O+BaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨不如金刚石稳定 | |
| B. | 石墨转变成金刚石是物理变化 | |
| C. | 等质量的金刚石与石墨完全燃烧,放出的能量一样多 | |
| D. | 等质量的金刚石与石墨完全燃烧,金刚石放出的能量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
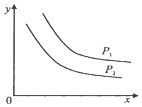 反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 上述反应是吸热反应 | ||
| C. | a>b | D. | a+1<b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提纯混有少量硝酸钾的氯化钠采用蒸发结晶,趁热过滤的方法 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入适量饱和Na2CO3溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2 mL 5% H2O2和1 mL H2O,向另一支试管中加2 mL 5% H2O2和1 mL FeCl3溶液,观察并比较实验现象 | |
| D. | 用KI滴定FeCl3溶液时选用淀粉作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
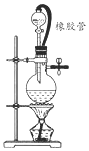 在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管.下列对其作用的叙述中正确的是( )
在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管.下列对其作用的叙述中正确的是( )| A. | 防止氯气造成大气污染 | |
| B. | 使反应的氯气循环使用 | |
| C. | 使烧瓶内的压强与大气压保持一致 | |
| D. | 使分液漏斗中的液体更容易注入烧瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com