
| A£® | Z”¢Y”¢X”¢WµÄŌ×Ó°ė¾¶ŅĄ“Ī¼õŠ” | |
| B£® | WÓėXŠĪ³ÉµÄ»ÆŗĻĪļÖŠÖ»ŗ¬Ąė×Ó¼ü | |
| C£® | WµÄĘųĢ¬Ēā»ÆĪļµÄ·ŠµćŅ»¶ØøßÓŚZµÄĘųĢ¬Ēā»ÆĪļµÄ·Šµć | |
| D£® | ČōX?Y?W×é³ÉµÄ¼ņµ„Ąė×Óµē×Ó²ć½į¹¹ĻąĶ¬£¬ŌņWĄė×Ó°ė¾¶×ī“ó£® |
·ÖĪö W”¢X”¢Y”¢ZĪŖ¶ĢÖÜĘŚŌŖĖŲ£¬W”¢ZĶ¬Ö÷×壬WµÄĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌ±ČZµÄĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌĒ棬¹ŹW”¢ZĪŖ·Ē½šŹō£¬Ō×ÓŠņŹżZ£¾W£¬W“¦ÓŚµŚ¶žÖÜĘŚ£¬Z“¦ÓŚµŚČżÖÜĘŚ£¬X”¢Y”¢ZĶ¬ÖÜĘŚ£¬X”¢YĪŖ½šŹōŌŖĖŲ£¬XµÄŃōĄė×ÓµÄŃõ»ÆŠŌŠ”ÓŚYµÄŃōĄė×ÓµÄŃõ»ÆŠŌ£¬ŌņŌ×ÓŠņŹżY£¾X£¬ĒŅ¶žÕß“¦ÓŚµŚČżÖÜĘŚ£¬øł¾ŻŃ”Ļī½ųŠŠÅŠ¶Ļ£®
½ā“š ½ā£ŗW”¢X”¢Y”¢ZĪŖ¶ĢÖÜĘŚŌŖĖŲ£¬W”¢ZĶ¬Ö÷×壬WµÄĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌ±ČZµÄĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌĒ棬¹ŹW”¢ZĪŖ·Ē½šŹō£¬Ō×ÓŠņŹżZ£¾W£¬W“¦ÓŚµŚ¶žÖÜĘŚ£¬Z“¦ÓŚµŚČżÖÜĘŚ£¬X”¢Y”¢ZĶ¬ÖÜĘŚ£¬X”¢YĪŖ½šŹōŌŖĖŲ£¬XµÄŃōĄė×ÓµÄŃõ»ÆŠŌŠ”ÓŚYµÄŃōĄė×ÓµÄŃõ»ÆŠŌ£¬ŌņŌ×ÓŠņŹżY£¾X£¬ĒŅ¶žÕß“¦ÓŚµŚČżÖÜĘŚ£¬X”¢Y”¢ZµÄŌ×ÓŠņŹżZ£¾Y£¾X£¬
A”¢W”¢ZĶ¬Ö÷×壬Ō×ÓŠņŹżZ£¾W£¬X”¢Y”¢ZĶ¬ÖÜĘŚ£¬X”¢Y”¢ZµÄŌ×ÓŠņŹżZ£¾Y£¾X£¬ĖłŅŌŌ×Ó°ė¾¶X£¾Y£¾Z£¾W£¬¹ŹA“ķĪó£»
B”¢ČōWÓėXŠĪ³ÉµÄ»ÆŗĻĪļĪŖ¹żŃõ»ÆÄĘ£¬¼Čŗ¬Ąė×Ó¼üÓÖŗ¬¹²¼Ū¼ü£¬¹ŹB“ķĪó£»
C”¢WµÄĘųĢ¬Ēā»ÆĪļĪŖ°±Ęų”¢Ė®”¢·ś»ÆĒāŹ±£¬·Ö×Ó¼ä“ęŌŚĒā¼ü£¬·ŠµćøßÓŚĶ¬×åĘäĖüĒā»ÆĪļµÄ·Šµć£¬WĪŖC”¢ZĪŖSiŹ±£¬WĒā»ÆĪļ·Šµć½ĻµĶ£¬¹ŹC“ķĪó£»
D”¢ČōX?Y?W×é³ÉµÄ¼ņµ„Ąė×Óµē×Ó²ć½į¹¹ĻąĶ¬£¬ŌņWĄė×ÓĪŖŅõĄė×Ó£¬X”¢YµÄĄė×ÓĪŖŃōĄė×Ó£¬ĖłŅŌWĄė×ӵİė¾¶×ī“󣬹ŹDÕżČ·£»
¹ŹŃ”D£®
µćĘĄ ±¾Ģāæ¼²éŌŖĖŲÖÜĘŚ±ķµÄ½į¹¹”¢ŌŖĖŲ»ÆŗĻĪļŠŌÖŹµČ£¬ĢāÄæÄŃ¶Č²»“ó£¬CŃ”ĻīĪŖŅדķµć£¬ČŻŅ×ÉóĢā²»×ŠĻø£¬Ōģ³É“ķĪ󣬽āĢāµÄ¹Ų¼üŹĒČ·¶ØŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĻą¶ŌĪ»ÖĆ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
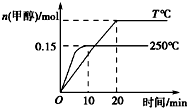 ½«1mol COŗĶ2mol H2³äČėŅ»ČŻ»żĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ£¬·Ö±šŌŚ250”ę”¢T”ę·¢Éś·“Ó¦£ŗCO£Øg£©+2H2£Øg£©?CH3OH£Øg£©”÷H=a kJ/mol£¬øł¾ŻĶ¼Ź¾ÅŠ¶Ļ£¬ĻĀĮŠ½įĀŪÕżČ·µÄŹĒ£Ø””””£©
½«1mol COŗĶ2mol H2³äČėŅ»ČŻ»żĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ£¬·Ö±šŌŚ250”ę”¢T”ę·¢Éś·“Ó¦£ŗCO£Øg£©+2H2£Øg£©?CH3OH£Øg£©”÷H=a kJ/mol£¬øł¾ŻĶ¼Ź¾ÅŠ¶Ļ£¬ĻĀĮŠ½įĀŪÕżČ·µÄŹĒ£Ø””””£©| A£® | a£¼0£¬T£¼250 | |
| B£® | 250”ꏱ£¬0”«10 minÄŚv£ØH2£©=0.015 mol/£ØL•min£© | |
| C£® | COµÄĘ½ŗā×Ŗ»ÆĀŹŌŚ250”ꏱ±ČT”ꏱ“ó | |
| D£® | 250”ꏱ£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠøijä1 mol CH3OHĘųĢ壬ŗćĪĀ“ļĘ½ŗāŗó£¬CH3OHµÄĪļÖŹµÄĮæ“óÓŚ0.15 mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | »¹ŌŠŌNa£¾Mg£¾Al | B£® | Ńõ»ÆŠŌCl2£¾S£¾P | ||
| C£® | ĖįŠŌH2SO4£¾H3PO4£¾HClO4 | D£® | ĪČ¶ØŠŌHCl£¾H2S£¾PH3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŗ¬1 mol NH3·Ö×Ó | B£® | ŗ¬NH3ŗĶNH4+Ö®ŗĶĪŖ1mol | ||
| C£® | ŗ¬NH3”¢NH4+”¢NH3•H2OÖ®ŗĶĪŖ1 mol | D£® | ŗ¬NH3•H2O 1mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2øö | B£® | 3øö | C£® | 4øö | D£® | 5øö |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
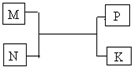 A”¢B”¢C”¢D”¢E”¢FŹĒ¶ĢÖÜĘŚŌŖĖŲ£¬ÖÜĘŚ±ķÖŠAÓėB”¢BÓėCĻąĮŚ£»CÓėEĶ¬Ö÷×壻AÓėC×īĶā²ćµē×ÓŹżÖ®±ČĪŖ2£ŗ3£¬BµÄ×īĶā²ćµē×ÓŹż±ČCµÄ×īĶā²ćµē×ÓŹżÉŁ1øö£» FŌŖĖŲµÄŌ×ÓŌŚÖÜĘŚ±ķÖŠ°ė¾¶×īŠ”£»³£¼ū»ÆŗĻĪļD2C2ÓėĖ®·“Ӧɜ³ÉCµÄµ„ÖŹ£¬ĒŅČÜŅŗŹ¹·ÓĢŖČÜŅŗ±äŗģ£®
A”¢B”¢C”¢D”¢E”¢FŹĒ¶ĢÖÜĘŚŌŖĖŲ£¬ÖÜĘŚ±ķÖŠAÓėB”¢BÓėCĻąĮŚ£»CÓėEĶ¬Ö÷×壻AÓėC×īĶā²ćµē×ÓŹżÖ®±ČĪŖ2£ŗ3£¬BµÄ×īĶā²ćµē×ÓŹż±ČCµÄ×īĶā²ćµē×ÓŹżÉŁ1øö£» FŌŖĖŲµÄŌ×ÓŌŚÖÜĘŚ±ķÖŠ°ė¾¶×īŠ”£»³£¼ū»ÆŗĻĪļD2C2ÓėĖ®·“Ӧɜ³ÉCµÄµ„ÖŹ£¬ĒŅČÜŅŗŹ¹·ÓĢŖČÜŅŗ±äŗģ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | īėµÄ½šŹōŠŌ±ČÄĘĒæ | B£® | ĀČ»ÆīėµÄŃõ»ÆŠŌ±ČĀČ»Æļ®Čõ | ||
| C£® | ĒāŃõ»ÆīėµÄ¼īŠŌ±ČĒāŃõ»ÆøĘČõ | D£® | µ„ÖŹīėŅ×øśĄäĖ®·“Ӧɜ³ÉH2 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com