
| A、标准状况下,22.4L H2O含有的分子数为NA |
| B、28g N2和N4组成的混合气体中含有的原子数为2NA |
| C、1mol?L-1 AlCl3溶液中含有的Cl-数目为3NA |
| D、2.3g Na与足量水反应,转移的电子数目为0.2NA |


科目:高中化学 来源: 题型:
 的化合物称为二肽,二肽还可以继续与其它α-氨基酸分子脱水形成三肽、四肽以至生成长链的多肽.若丙氨酸[CH3CH(NH2)COOH]与甘氨酸[H2N-CH2-COOH]的混合物在一定条件下反应,可形成
的化合物称为二肽,二肽还可以继续与其它α-氨基酸分子脱水形成三肽、四肽以至生成长链的多肽.若丙氨酸[CH3CH(NH2)COOH]与甘氨酸[H2N-CH2-COOH]的混合物在一定条件下反应,可形成查看答案和解析>>
科目:高中化学 来源: 题型:
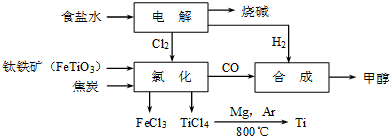
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | ||||
B、工业制备氯气:2NaCl+2H2O
| ||||
| C、金属钠与足量盐酸反应:2Na+2H+=2Na++H2↑ | ||||
| D、硫酸溶液中滴加氢氧化钡溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、随着盐酸的逐滴加入,水电离的c(OH-)总是逐渐减小 |
| B、当滴入10mL盐酸时,溶液中:c(NH4+)十c(NH3?H2O)=2c(Cl-) |
| C、当滴入20mL盐酸时,溶液中:c(Cl-)十c(H+)=c(NH4+)十c(OH-) |
| D、水电离过程的热化学方程式可表示为:H2O(l)?H+(aq)+OH-(aq)△H=(b-a)kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-+OH -=H2O+CO32- |
| B、CO32-+2H+=H2O+CO2↑ |
| C、Fe+2H+=Fe2++H2↑ |
| D、Cl2+H2O=H++Cl -+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入铝粉有氢气产生的溶液中:Na+、SO42-、C1-、K+ |
| B、pH=0的无色溶液中:Na+、K+、MnO4-、NO3- |
| C、在0.1mol/L的盐酸溶液中:Fe2+、Na+、ClO-、Ca2+ |
| D、在c(H+)/c(OH-)=1×1013的溶液中:NH4+、Ca2+、C1-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com