
���� ��1�����ݻ�ѧ�����������������������������Ʊ���������ķ����������������ƺ�Ũ���ᷴӦ���ɣ�
��2�����ö�����������������Һ���������������Ƶ�������ԭ��Ӧ��������Ӧ��������ʣ������������ʺ͵���غ㣬ԭ���غ���ƽ��д���ӷ���ʽ��
��3�����ݶ���������ʹƷ����ɫ����������ɫ�����Һ�ֿɻָ���ɫ�����
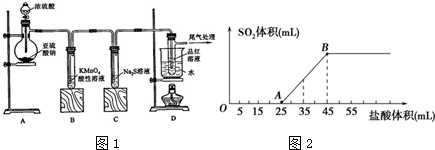
��4��������Һ���������������������Ʒ�Ӧ�����������ƣ����ͼ���֪����ʼû�ж��������������ɣ����Ũ��NaOH��Һ������Һ�е�����Ϊ�������ƺ��������ƣ���OA���ȷ�������кͣ��ٷ����������������ᷴӦ�����������������Ȼ��ƣ�A����Һ�е�����Ϊ�����������Ȼ��ƣ�
�ڽ��ͼ���֪��������35mL����ʱ��25��35mL����̼������������ķ�Ӧ���ɶ����������壮
��� �⣺��1��װ��A��ʢ���������Ƶ�����������������ƿ������������Ũ���ᷴӦ��Ӧ���������ơ��������������ˮ����Ӧ�Ļ�ѧ����ʽΪ��Na2SO3+H2SO4��Ũ��=Na2SO4+SO2��+H2O��
�ʴ�Ϊ��������ƿ��Na2SO3+H2SO4��Ũ��=Na2SO4+SO2��+H2O��
��2�����������ҺΪ�Ϻ�ɫ�����������ԣ�����������л�ԭ�ԣ����߷���������ԭ��Ӧ����۲쵽��ɫ��dzֱ����ȫ��ȥ�������������������Һ�з�����������ԭ��ӦΪ2S2-+SO2+2H2O=3S��+4OH-����۲쵽��ɫ��Һ���ֻ�ɫ���ǣ����������Һ�Ͷ����������巢�������ӷ�ӦΪ��5SO2+2MnO4-+2H2O�T2Mn2++5SO42-+4H+��
�ʴ�Ϊ����Һ��ɫ��ȥ����ɫ��Һ���ֻ�ɫ���ǣ�5SO2+2MnO4-+2H2O�T2Mn2++5SO42-+4H+��
��3�������������ʹƷ����ɫ����������ɫ�����Һ�ֿɻָ���ɫ�������Ϊ��Ʒ����Һ��ȫ��ɫ�رշ�Һ©������������ȼ�ƾ��Ƽ��ȣ��۲쵽������Ϊ��ɫ��Һ�ָ�Ϊ��ɫ��
�ʴ�Ϊ��Ʒ����Һ��ɫ�رշ�Һ©����������ȼ�ƾ��Ƽ��ȣ���Һ�ָ���ɫ��
��4��������Һ���������������������Ʒ�Ӧ�����������ƣ����ͼ���֪����ʼû�ж��������������ɣ����Ũ��NaOH��Һ������Һ�е�����Ϊ�������ƺ��������ƣ���OA��0��25mL�ȷ�������кͣ������ӷ�Ӧ����ʽΪH++OH-�TH2O���ٷ����������������ᷴӦ�����������������Ȼ��ƣ������ӷ�Ӧ����ʽΪSO32-+H+�THSO3-��A����Һ�е�����Ϊ�����������Ȼ��ƣ�
�ʴ�Ϊ��NaC1��NaHSO3��
�ڽ��ͼ���֪��������35mL����ʱ��25��35mL����̼������������ķ�Ӧ���ɶ����������壬�����ɶ�����������ʵ���Ϊn����������ʱ���ĵ�������ʵ���Ϊ��35-25����10-3L��1mol•L-1=0.01mol����
HSO3-+H+�TSO2��+H2O
1 1
0.01mol n
$\frac{1}{1}$=$\frac{0.01mol}{n}$�����n=0.01mol����״���������Ϊ0.01mol��22.4L/mol=0.224L=224mL��
�ʴ�Ϊ��224mL��0.224L��
���� ���⿼���˶����������ȡ���������������ʵ�飬��Ŀ�Ѷ��еȣ���ȷ��Ӧ���Ⱥ�˳��ͼ����ÿ��ͼ���Ӧ�Ļ�ѧ��Ӧ�ǽ����Ĺؼ���ע�����ն�����������ʼ�����ʵ�鷽����Ʒ���ԭ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ú��ʯ�Ͷ��ǻ�����ֻ��̼��������Ԫ����� | |
| B�� | ú��������Һ�����������仯 | |
| C�� | ú�ĸ����ʯ�͵ķ������Ķ��ǻ�ѧ�仯 | |
| D�� | ��������Ȼ�̼��Һ�ɼ���ֱ�����ͺ��ѻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | FeO��Fe2O3 | B�� | CO2��CO | C�� | H2S��Na2S | D�� | AlCl3��Al��OH��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4�� | B�� | 2�� | C�� | 3�� | D�� | 1�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 12g����NaHSO4�к��������ӵ�����Ϊ0.1NA | |
| B�� | 0.1mol Cl2ȫ������ˮ��ת�Ƶ��ӵ���ĿΪ0.1NA | |
| C�� | �����£�pH=2�Ĵ�����Һ�������е�H+��Ϊ0.01NA | |
| D�� | �ϳɰ���Ӧ��ƽ��ʱ��ÿ����3NA�����������������3NA������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������0.5Lˮ | B�� | �����ͨ��44.8L HCl���� | ||
| C�� | ����Һ��������Ũ����0.5L | D�� | ����6mol/L����1L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2N2��g��+O2��g���T2N2O��g����H=+163 kJ•mol-1 | |
| B�� | 2Ag��s��+Cl2��g���T2AgCl��s����H=-127 kJ•mol-1 | |
| C�� | 2HgO��s���T2Hg��l��+O2��g����H=+91 kJ•mol-1 | |
| D�� | 2H2O2��l���TO2��g��+2H2O��l����H=-98 kJ•mol-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com