
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
请回答下列问题:
(1)当反应①转移3摩尔电子时,消耗H2SO4的质量是______g,产生氢气的体积(标准状况)_________L。
(2)反应②中_________作氧化剂,___________是氧化产物。
(3)当反应②中生成11.2LSO2气体(标准状况下)时,被还原的H2SO4的物质的量是____________。
(4)用单线桥法表示反应③电子转移的方向和数目。KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
______________
(5)反应③中盐酸表现_________________性。
【答案】147 33.6 H2SO4 CuSO4 0.5mol  酸性和还原
酸性和还原
【解析】
(1)反应①Fe+H2SO4(稀)=FeSO4+H2↑中,Fe元素化合价从0价升高为+2价,即溶解1molFe转移2mol电子,则当反应①转移3摩尔电子时,消耗H2SO4和生成氢气的物质的量均为1.5mol,硫酸质量是1.5mol×98g/mol=147g,产生氢气的体积(标准状况)为1.5mol×22.4L/mol=33.6L;
(2)反应②Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑中S元素从+6价降为+4价,则硫酸被还原,作氧化剂,Cu是还原剂,CuSO4是氧化产物;
CuSO4+2H2O+SO2↑中S元素从+6价降为+4价,则硫酸被还原,作氧化剂,Cu是还原剂,CuSO4是氧化产物;
(3)11.2LSO2气体(标准状况下)的物质的量为![]() =0.5mol,则反应②Cu+2H2SO4(浓)
=0.5mol,则反应②Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑中生成0.5molSO2气体时,被还原的H2SO4的物质的量是0.5mol;
CuSO4+2H2O+SO2↑中生成0.5molSO2气体时,被还原的H2SO4的物质的量是0.5mol;
(4)反应中KClO3为氧化剂,得电子,HCl为还原剂,失电子,由化合价的变化可知转移电子方向和数目可表示为 ;
;
(5)反应③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中Cl元素部分从-1价升高为0价,则盐酸表现酸性和还原性;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)===2NH3(g) △H=-92.4kJ·mol-1)
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收 c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 |
|
|
|
下列说法正确的是( )
A. 2c1>c3B. a+b=92.4C. 2p2<p3D. ![]() 1+
1+![]() 3>1
3>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇酸树脂,附着力强,并具有良好的耐磨性、绝缘性等,在油漆、涂料、船舶等方面有很广的应用。下面是一种醇酸树脂G的合成路线:

已知:RCH2=CH2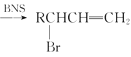
(1)反应①的反应条件为___________________,合成G过程中会生成另一种醇酸树脂,其结构简式为____________________________________
(2)反应②⑤反应类型分别为________、________;
(3)反应④的化学方程式为________;
(4)写出一种符合下列条件的F的同分异构体________。
a.1mol该物质与4mol新制氢氧化铜悬浊液反应
b.遇FeCl3溶液显紫色
c.核磁共振氢谱有3组峰值,比值为1:1:1
(5)设计由1一溴丙烷制备聚丙烯醇(![]() )的流程图:________。
)的流程图:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2L甲烷、乙烷、HCHO(g)组成的混合气体,完全燃烧后生成15.68LCO2(气体体积均在标准状况下测定),混合气体中甲烷的体积分数可能为
A. 40%B. 60%C. 70%D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘,可经过以下实验步骤完成。下列有关说法正确的是
![]()
A. 灼烧过程中使用的玻璃仪器有酒精灯、烧杯、玻璃棒
B. 氧化过程中发生反应的离子方程式为 2I-+H2O2 =I2+2OH-
C. 检验碘单质时,可选用淀粉碘化钾试纸,若试纸变蓝说明海带中含有碘单质
D. 分液时,先打开活塞放出下层液体,再关闭活塞从上口倒出上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)除去自来水中的Ca2+、Mg2+、Cl-、SO42-等杂质,选择装置___(填代表装置图的字母)。
(2)用CCl4萃取碘水中的I2,有机层的颜色为___。
(3)装置A中①的名称是___,进水的方向是___,装置B在分液时为使液体顺利滴下,应进行的具体操作是___。
(4)海水中蕴藏着丰富的资源。在实验室中取少量海水,进行如下流程的实验: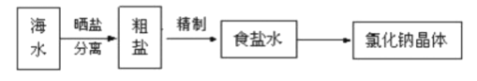
问题:粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液④调节溶液的pH等于7:⑤溶解;⑥过滤;⑦蒸发。
正确的操作顺序是___(填写字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤③②①⑥④⑦ d.⑤②①③⑥④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2mol 某烃 A 在氧气中完全燃烧后,生成CO2和H2O各1.2mol 。试回答:
(1)烃A的分子式为______________。
(2)若取一定量的该烃 A完全燃烧后,生成CO2和H2O各3mol ,则有______ g 烃 A参加了反应,燃烧时消耗标准状况下的氧气______ L 。
(3)若烃 A 不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃 A 的结构简式为______。
(4)若烃 A 能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有 4个甲基,烃A可能有的结构简式为(写一种即可)______________。
(5)比烃 A 少一个碳原子且能使溴水褪色的 A 的同系物有______种同分异构体(包括顺反异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
已知:lg2=0.3,Ksp(ZnS)=3×10-25 mol2/L2。
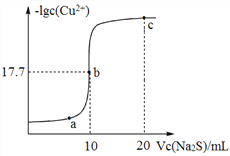
A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=4×10-36 mol2/L2
D. 向100 mL Zn2+、Cu2+浓度均为10-5 molL-1的混合溶液中逐滴加入10-4 molL-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)被氧化的元素是________,被还原的元素是______。
(2)发生氧化反应的物质是__________,发生还原反应的物质是__________。
(3)用双线桥法表示反应电子得失的方向和数目__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com