
【题目】钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态 K 原子中,核外电子占据的最高能层的符号是_____,占据该能层电子的电子云轮廓图形状为_____。K 和 Cr 属于同一周期,且核外最外层电子构型相同,但金属 K 的熔 点、沸点等都比金属 Cr 低,原因是_____。
(2)X 射线衍射测定等发现,I3AsF6 中存在 I3+ 离子。I3+ 离子的几何构型为____________,中心原子的杂化类型为_______________ 。
(3)KIO3 晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结 构,边长为 a=0.446nm,晶胞中 K、I、O 分别处于顶角、体心、面心位置, 如图所示。K 与 O 间的最短距离为_____nm,与 K 紧邻的 O 个数为_____。
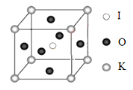
(4)在 KIO3 晶胞结构的另一种表示中,I 处于各顶角位置,则 K 处于_____________位置,O 处于_____位置。
【答案】![]() 球形
球形 ![]() 原子半径较大且价电子较少,金属键较弱
原子半径较大且价电子较少,金属键较弱 ![]() 形
形 ![]() 0.315 12 体心 棱心
0.315 12 体心 棱心
【解析】
(1)![]() 在元素周期表是19号元素,电子排布式为
在元素周期表是19号元素,电子排布式为 ![]() ,能层从低到高依次是
,能层从低到高依次是 ![]() ,
,![]() ,
,![]() ,
,![]() ……;所以占据最高能层符号为
……;所以占据最高能层符号为 ![]() ;占据该能层的电子轨道为
;占据该能层的电子轨道为![]() 轨道,电子云轮廓图形状为球形;
轨道,电子云轮廓图形状为球形;![]() 和
和![]() 处于同一周期,且核外最外层电子构型相同,但
处于同一周期,且核外最外层电子构型相同,但 ![]() ,且
,且![]() 的价电子少于
的价电子少于![]() ,则
,则![]() 的金属键比
的金属键比![]() 弱,因此K的熔点、沸点比
弱,因此K的熔点、沸点比![]() 低;
低;
(2)![]() 中心
中心 ![]() 原子形成
原子形成 ![]() 个
个 ![]() 键,孤电子对数
键,孤电子对数 ![]() ,即中心
,即中心 ![]() 原子形成
原子形成 ![]() 个
个 ![]() 键,还有
键,还有 ![]() 对孤电子对,故中心
对孤电子对,故中心 ![]() 原子采取
原子采取 ![]() 杂化;因为
杂化;因为 ![]() 只有三个原子,所以
只有三个原子,所以 ![]() 几何构形为
几何构形为 ![]() 形;
形;
(3)![]() 与
与 ![]() 的最短距离如图所示,是面对角线的
的最短距离如图所示,是面对角线的![]() ,所以
,所以![]() 与
与![]() 的最短距离
的最短距离![]() ;
;![]() 原子的堆积方式相当于面心立方堆积,所以与
原子的堆积方式相当于面心立方堆积,所以与 ![]() 原子相邻的
原子相邻的![]() 原子个数为12个;
原子个数为12个;
(4)![]() 个,
个,![]() 个,
个,![]() 个,所以
个,所以![]() 原子处于体心,
原子处于体心,![]() 原子处于棱心。
原子处于棱心。


科目:高中化学 来源: 题型:
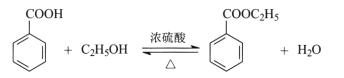
【题目】苯甲酸乙酯可由苯甲酸与乙醇在浓硫酸共热下反应制得,反应装置如图(部分装置省略),反应原理如下:
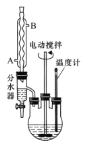
实验操作步骤:
①向三颈烧瓶内加入12.2g苯甲酸、25mL乙醇、20mL苯及4mL浓硫酸,摇匀,加入沸石。
②装上分水器、电动搅拌器和温度计,加热至分水器下层液体接近支管时将下层液体放入量筒中。继续蒸馏,蒸出过量的乙醇,至瓶内有白烟(约3h),停止加热。
③将反应液倒入盛有80mL冷水的烧杯中,在搅拌下分批加入碳酸钠粉末至溶液无二氧化碳逸出,用pH试纸检验至呈中性。
④用分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层。用无水CaC12干燥,粗产物进行蒸馏,低温蒸出乙醚。当温度超过140℃时,直接接收210-213℃的馏分,最终通过蒸馏得到纯净苯甲酸乙酯12.8mL。
可能用到的有关数据如下:
相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
苯甲酸 | 122 | 1.27 | 249 | 微溶于水,易溶于乙醇、乙醚 |
苯甲酸乙酯 | 150 | 1.05 | 211-213 | 微溶于热水,溶于乙醇、乙醚 |
乙醇 | 46 | 0.79 | 78.5 | 易溶于水 |
乙醚 | 74 | 0.73 | 34.5 | 微溶于水 |
回答以下问题:
(1)反应装置中分水器上方的仪器名称是______,其作用是____
(2)步骤①中加浓硫酸的作用是_________,加沸石的目的是______。
(3)步骤②中使用分水器除水的目的是_________。
(4)步骤③中加入碳酸钠的目的是________ 。
(5)步骤④中有机层从分液漏斗的____(选填“上口倒出”或“下口放出”)。
(6)本实验所得到的苯甲酸乙酯产率是________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )
CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )

A. 图Ⅰ研究的是t0时升高温度对反应速率的影响
B. 图Ⅱ研究的是t0时增大压强(缩小容积)或使用催化剂对反应速率的影响
C. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。
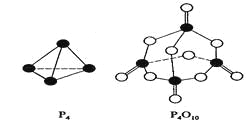
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,将agNH3完全溶于水,得到VmL溶液,设该溶液的密度为ρgcm-3,质量分数为ω,其中含NH4+的物质的量为bmol。下列叙述中不正确的是( )
A.溶质的质量分数为ω=![]() ×100%
×100%
B.溶质的物质的量浓度c=![]() molL-1
molL-1
C.溶液中c(OH-)=![]() mol/L
mol/L
D.上述溶液中再加入VmL水后,所得溶液中溶质的质量分数小于0.5ω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Na+、NH4+、SO42-、SO32-、Cl-、Fe2+、Fe3+、CO32-中的若干种,且各离子浓度均相同。为确定其组成现进行如下实验:
①向溶液中加入足量硝酸酸化的Ba(NO3)2溶液,产生白色沉淀,过滤
②向①中的滤液加入足量NaOH溶液,有沉淀生成,微热,有气体产生
下列说法正确的是( )
A.无法确定原溶液中是否存在SO32-
B.是否存在![]() 需要通过焰色反应来确定
需要通过焰色反应来确定
C.CO32-肯定不存在,Fe2+、Fe3+至少有一种
D.溶液中存在NH4+、SO42-、Cl-、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】8.34 g FeSO4·7H2O(相对分子质量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是
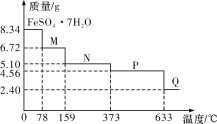
A.温度为78 ℃时固体物质M的化学式为FeSO4·5H2O
B.温度为159 ℃时固体N的化学式为FeSO4·2H2O
C.取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体物质Q,同时只得到一种无色气体生成
D.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O
FeSO4+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,改变0.1 molL-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() (X)随pH的变化如图所示[已知]
(X)随pH的变化如图所示[已知]![]() (X)=
(X)=![]() 。下列叙述错误的是( )
。下列叙述错误的是( )

A.pH=1.2时, c(K+)+c(H+)=c(H2A) + c(OH-)+2c(A2-)
B.常温下,H2A的电离平衡常数Ka2 =10-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.KHA溶液中粒子浓度为c(K+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用有机物甲可制备环己二烯(![]() ),其反应路线如图所示:
),其反应路线如图所示:

下列有关判断不正确的是
A.甲的分子式为 C6H12
B.乙与环己二烯互为同系物
C.上述流程发生的反应类型有取代反应、消去反应、加成反应
D.环己二烯与溴水 1:1 反应可得 2 种产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com