
 有一套实验装置,如图所示,可完成高中化学多种实验.装置①②③④中可以装试剂,也可用于气体的收集.
有一套实验装置,如图所示,可完成高中化学多种实验.装置①②③④中可以装试剂,也可用于气体的收集.
| ||
| ||


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
 黄曲霉素的结构如图,1mol该化合物分别与H2、NaOH溶液反应,最多消耗H2和NaOH分别为( )
黄曲霉素的结构如图,1mol该化合物分别与H2、NaOH溶液反应,最多消耗H2和NaOH分别为( )| A、6 mol 2 mol |
| B、7 mol 2 mol |
| C、6 mol 1 mol |
| D、7 mol 1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验目的 | 实验操作 |
| A | 验证SO2具有漂白性 | 将SO2通入品红溶液中,品红溶液褪色 |
| B | 验证Fe2+的还原性 | FeCl2溶液中加入酸性KMnO4溶液,KMnO4溶液褪色 |
| C | 检验尿液中是否含有葡萄糖 | 在尿液中加新制的Cu(OH)2悬浊液加热至沸腾 |
| D | 验证Na2CO3溶液中存在水解平衡 | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 仪器 |  |
 |
 |
 |
| 名称 |
查看答案和解析>>
科目:高中化学 来源: 题型:
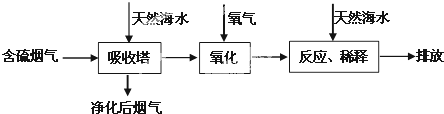
| 难溶 电解质 |
AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-12 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com