
| A. | 用食盐腌制食物 | B. | 用盐酸除去铁钉表面的铁锈 | ||
| C. | 用液氨作制冷剂 | D. | 用漂粉精消毒游泳池中的水 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25.0mL | B. | 35.0mL | C. | 17.5mL | D. | 7.5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化氮 | B. | 二氧化硫 | ||
| C. | 一氧化氮 | D. | 甲醛和苯、甲苯等有机物气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火,不能用泡沫灭火器扑火 | |
| B. | 实验台上的酒精灯碰翻着火,立即用湿抹布扑火 | |
| C. | 皮肤溅上浓硫酸,立即用大量水冲洗 | |
| D. | 汞洒落地面,应立即撒上一层硫磺粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.6mol/(L•min) | ||
| C. | v(C)=0.4mol/(L•min) | D. | v(D)=0.0075 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
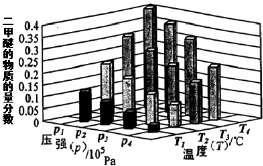
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.4NA | |
| B. | 18gD2O中含有的质子数目为10NA | |
| C. | 1molCl2发生反应时,转移的电子数一定是2NA | |
| D. | 常温常压下,16gO3所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
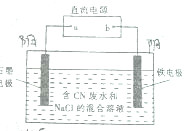 工业上,在强碱性条件下用电解法除去废水中的CN-,装制如图所示,依次发生的反应有:
工业上,在强碱性条件下用电解法除去废水中的CN-,装制如图所示,依次发生的反应有:| A. | a是电源的正极 | |
| B. | 铁电极上发生的电极反应式为2H++2e-═H2↑ | |
| C. | 为了使电解池连续工作,需要不断补充NaOH | |
| D. | 除去1mol CN-,电解过程中共产生标准状况下11.2L气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com