
| A. | 第3周期第ⅠA族 | B. | 第4周期第ⅠA族 | C. | 第5周期第ⅠA族 | D. | 第3周期第ⅡA族 |
分析 根据质量数=质子数+中子数,计算出该同位素镤-239的质子数,再计算出A元素的质子数,根据质子数确定其在元素周期表中的物质.用质子数分别减去各周期所含有的元素种数.
解答 解:同位素镤-239的质子数为239-148=91,
所以A元素的质子数为91-54=37.
37-2-8-8-18=1
所以A位于第5周期第IA族.
故选:C.
点评 考查结构与位置关系,难度不大.已知元素的原子序数确定元素在周期表中位置的方法:1、根据每周期容纳元素的种数:第一至第六周期每周期容纳元素的种数分别为2、8、8、18、18、32,用元素的原子序数减去每一周期容纳元素种数,当余数小于某周期容纳元素种数时,元素处于该周期,如114号元素:114-2-8-8-18-18-32=28<32(第七周期排满容纳元素种数),所以114号元素应位于第七周期.2、记住118号元素在周期表中的位置:第七周期0族元素(元素周期表的第18纵行,与元素原子序数的后两位数字相同),故114号元素应位于周期表的第七周期第十四纵行,即第IVA主族.3、根据核外电子排布判断.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
| 粒子代号 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
 ,G的化学式是CH4.
,G的化学式是CH4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
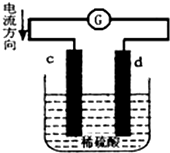 将锌片和铜片同时插入100mL 稀硫酸中,组成的原电池装置如图所示(c、d为两个电极,电池工作过程中溶液体积不变).下列有关判断不正确的是( )
将锌片和铜片同时插入100mL 稀硫酸中,组成的原电池装置如图所示(c、d为两个电极,电池工作过程中溶液体积不变).下列有关判断不正确的是( )| A. | 当电路中通过2 mol 电子时,d 极可以生成22.4 L H2 | |
| B. | 当电路中通过0.1 mol 电子时,溶液中c(Zn2+)=0.5 mol•L-1 | |
| C. | c为负极,发生氧化反应 | |
| D. | 电池工作完成后,溶液中SO42-浓度基本不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaO2的水解产物是Ba(OH)2和H2O2 | B. | PCl3的水解产物是HClO和H3PO4 | ||
| C. | A14C3的水解产物是Al(OH)3和CH4 | D. | CH3COCl的水解产物是两种酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石能源物质内部贮存着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能贮存起来 | |
| C. | 物质的化学能可以在不同条件下转化为热能、电能为人类所利用 | |
| D. | 吸热反应中由于反应物的总能量小于生成物的总能量,因而没有利用价值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
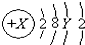 .则下列说法正确的是( )
.则下列说法正确的是( )| A. | 3p能级上的电子数只能为6 | |
| B. | 3d能级上的电子数可能为1-10 | |
| C. | Y可只能为3-8 | |
| D. | 2p,3p能级上的电子数可以相同,也可以不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象与结论 | |
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的3mol/LH2SO4,振荡溶解,过滤后将滤液配成250mL溶液,待用. | - |
| 步骤2 | 取少量步骤1中滤液于试管中,滴加1~2滴20%KSCN | 溶液变红色,则固体产物含+3价铁 |
| 步骤3 | 取少量步骤1中滤液于试管中,滴加1~2滴0.01mol/LKMnO4 | 溶液紫色褪去,则固体产物含+2价铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧不一定有氧气参加,也不一定是放热反应 | |
| B. | 火箭点火后,喷出的红色火焰是金属的焰色反应产生的 | |
| C. | 火箭燃料燃烧主要是将化学能转变为热能和光能,可能对环境产生污染 | |
| D. | 偏二甲肼燃烧的热化学方程式是:C2H8N2(g)+2N2O4(g)═2N2(g)+2CO2(g)+4H2O(g);△H=-2550kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com