
分析 (1)根据c=$\frac{1000ρω}{M}$计算出密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度;
(2)20%发烟硫酸可表示为SO3•nH2O,通过整理即为:nH2SO4•(1-n)SO3,根据20%发烟硫酸中H2SO4和SO3的质量关系可得:98n:80(1-n)=(1-20%):20%,解出n即可;
(3)根据沉淀9.32克为硫酸钡、氯气的物质的量计算出铁离子和亚铁离子的物质的量、再根据质量关系计算出含有的结晶水的质量,最后计算出晶体的化学式;
(4)①采用极限法计算与固体混合物反应需要的硝酸的物质的量,剩余的硝酸与(NH4)2Fe(SO4)2溶液反应计算需要的(NH4)2Fe(SO4)2溶液的体积;
②先根据(NH4)2Fe(SO4)2的物质的量计算与其反应的硝酸的物质的量,设固体混合物中两固体的质量,根据两固体的质量计算需要的硝酸的物质的量,然后列式计算出两固体的质量,根据质量分数公式计算即可.
解答 解:(1)密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度为:$\frac{1000×1.4×50%}{98}$mol/L≈7.14mol/L;故答案为:7.14 mol•L-1;
(2)20%发烟硫酸可表示为SO3•nH2O,通过整理即为:nH2SO4•(1-n)SO3,根据20%发烟硫酸中H2SO4和SO3的质量关系可得:98n:80(1-n)=(1-20%):20%,解得n=0.77,
故答案为:0.77;
(3)硫酸钡的物质的量为:$\frac{9.32g}{233g/mol}$=0.04mol,即n(FeSO4)+3n(Fe2(SO4)3)=0.04mol,标况下112mL氯气的物质的量为:$\frac{112×1{0}^{-3}}{22.4L/mol}$=0.005mol,根据反应关系式2Fe2+~Cl2可知,硫酸亚铁的物质的量为:n(FeSO4)=n(Fe2+)=2n(Cl2)0.01mol,则3n(Fe2(SO4)3)=0.04mol-0.01mol=0.03mol,7.32克晶体中结晶水的质量为:m(H2O)=7.32g-152g/mol×0.01mol-400g/mol×0.01mol=1.8g,结晶水的物质的量为:n(H2O)=$\frac{1.8g}{18g/mol}$=0.1mol,所以绿矾晶体中硫酸亚铁、硫酸铜、水的物质的量之比为0.01mol:0.01mol:0.1mol=1:1:10,所以晶体的化学式为FeSO4•Fe2(SO4)3•10H2O,
故答案为:FeSO4•Fe2(SO4)3•10H2O;
(4)①硝酸的物质的量为:0.20L×2mol/L=0.4mol,
假设固体混合物全部为Cu2S,则n(Cu2S)=$\frac{8.64g}{160g/mol}$=0.054mol,需要是硝酸的物质的量为x,
10NO3-+3Cu2S+16H+→6Cu2++10NO↑+3SO42-+8H2O
3 16
0.054mol x
x=$\frac{0.054mol×16}{3}$=0.288mol,
剩余的硝酸的物质的量为:0.4mol-0.288mol=0.112mol,
0.112mol硝酸和(NH4)2Fe(SO4)2溶液完全反应.
NO3-+3Fe2++4H+→NO↑+3Fe3++2H2O
3mol 4
1×10-3VL×2mol/L 0.112mol
解得V=42,
假设固体混合物全部为CuS,则n(CuS)=$\frac{8.64g}{96g/mol}$=0.09mol,需要硝酸的物质的量为y,
8NO3-+3CuS+8H+→3Cu2++3SO42-+8NO↑+4H2O,
3 8
0.09mol y
y=$\frac{0.09mol×8}{3}$=0.24mol
剩余的硝酸的物质的量为:0.4mol-0.24mol=0.16mol.
0.112mol硝酸和(NH4)2Fe(SO4)2溶液完全反应.
NO3-+3Fe2++4H+→NO↑+3Fe3++2H2O
3mol 4
1×10-3VL×2mol/L 0.16mol
解得V=60,
所以V值范围为:42<V<60,
故答案为:42<V<60;
②若V=48,与48mL(NH4)2Fe(SO4)2溶液完全反应需要硝酸的物质的量为:
NO3-+3Fe2++4H+→NO↑+3Fe3++2H2O
3mol 4
0.048L×2mol/L n
解得:n=0.128mol,
所以消耗的硝酸的物质的量为0.128mol,
故与固体混合物反应的硝酸的物质的量为:0.4mol-0.128mol=0.272mol,
设Cu2S的物质的量xmol,CuS的物质的量为ymol,160x+96y=8.64g①.
10NO3-+3Cu2S+16H+→6Cu2++10NO↑+3SO42-+8H2O
3 16
x $\frac{16x}{3}$
8NO3-+3CuS+8H+→3Cu2++3SO42-+8NO↑+4H2O,
3 8
y $\frac{8y}{3}$
$\frac{16}{3}$x+$\frac{8}{3}$y=0.272②
由①②解得:x=0.036 y=0.03,
合物中CuS的质量分数为:$\frac{96g/mol×0.03mol}{8.64g}$×100%≈33.33%,
答:混合物中CuS的质量分数为33.33%.
点评 本题考查了物质的量浓度的计算、复杂化学式的确定、化学方程式的计算等知识,题目难度较大,涉及的计算量稍大,注意掌握物质的量概念及表达式,明确根据化学方程式进行计算的方法,其中(4)为难点,涉及到极端讨论法解题.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 维生素C属于水溶性维生素 | B. | 维生素C是一种较强的还原剂 | ||
| C. | 维生素C水溶液显碱性,味道可口 | D. | 维生素C主要存在于蔬菜和水果中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气过量 | B. | 使用催化剂 | C. | 400℃~500℃的高温 | D. | 常压 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)=2×10-7mol/L | B. | c(OH-)=5×10-8mol/L | ||
| C. | 无法确定OH-浓度 | D. | 该温度低于室温 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
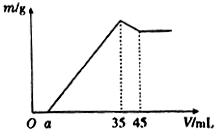 准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol•L-l的NaoH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示,则所用硫酸溶液的物质的量浓度为( )
准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol•L-l的NaoH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示,则所用硫酸溶液的物质的量浓度为( )| A. | 3.50mol/L | B. | 1.75mol/L | C. | 0.85mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3与水共热 | |
| B. | 少量氯化铝溶液滴入氢氧化钠溶液中 | |
| C. | 少量偏铝酸钠溶液滴入硫酸中 | |
| D. | 足量氨水加入氯化铝溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出],t1时刻达到平衡,反应过程中混合气体的平均相对分子质量始终不变.下列说法正确的是( )
向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出],t1时刻达到平衡,反应过程中混合气体的平均相对分子质量始终不变.下列说法正确的是( )| A. | 该容器的体积为2L | |
| B. | 起始时B的物质的量为0.08mol | |
| C. | 该反应的方程式为3A=2C+B | |
| D. | 若t1=15 s,则用B的浓度变化表示的t0~t1阶段的平均反应速率为0.002 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此合金的熔点比镁和铝的熔点都高 | |
| B. | 此合金能全部溶解于稀盐酸中 | |
| C. | 此合金能全部溶解于氢氧化钠溶液中 | |
| D. | 此合金的硬度比镁和铝的硬度都小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com