
【题目】某研究性学习小组得到一块软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2)。为了制取氯气并进行氯气的性质实验,其装置如图所示,请回答下列问题:
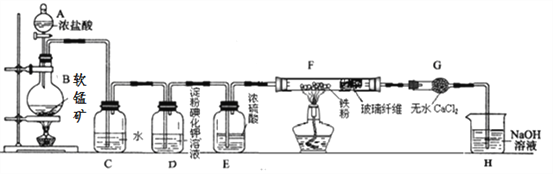
(1)取适量软锰矿置于烧瓶中,加入足量浓盐酸并加热,烧瓶中发生的化学反应为:MnO2 +4HCl(浓)![]() MnCl2+Cl2↑+2H2O。充分反应后烧瓶中残留的固体是____________;若有4mol浓盐酸参与反应,产生的氯气在标准状况下的体积为____22.4L (填“等于”、“小于”或“大于”),浓盐酸在该反应中表现出来的性质_______________________;
MnCl2+Cl2↑+2H2O。充分反应后烧瓶中残留的固体是____________;若有4mol浓盐酸参与反应,产生的氯气在标准状况下的体积为____22.4L (填“等于”、“小于”或“大于”),浓盐酸在该反应中表现出来的性质_______________________;
(2)若将干燥的有色布条放入C中,观察到的现象是 ______ ,原因是 ______________ (用化学方程式和文字回答);
(3)实验中观察到D溶液变蓝色,写出D装置中发生反应的离子方程式 ____________ ;
(4)为探究氯气与Fe反应的产物与氯气通入量的关系,设计实验,并记录现象如下:
实验方法 | 实验现象 | 实验结论 |
1.取反应初始阶段(氯气不足量)F中产物,用磁铁除去过量的Fe,剩余产物溶于水中,取上层溶液装入两只试管中,①加入KSCN溶液,②加入KMnO4溶液 | ①KSCN溶液显红色 ②KMnO4溶液不褪色 | (不填) |
2.取充分反应后(氯气通入足够长时间)F中产物,溶于水中,加入KMnO4溶液 | KMnO4溶液不褪色 |
根据实验现象,得出实验结论,写出氯气与Fe粉共热时发生反应的化学方程式______;
(5)已知F中的产物易潮解,在F和H装置之间安装G装置,目的是_________________。
【答案】 SiO2 小于 酸性和还原性 有色布条褪色 Cl2+H2O=HCl+HClO,HClO具有漂白性,能使有色布条褪色 2I-+Cl2=I2+2Cl- 2Fe+3Cl2![]() 2FeCl3 防止H中的水蒸气进入到F装置中(或者吸收H中挥发出来的水蒸气)
2FeCl3 防止H中的水蒸气进入到F装置中(或者吸收H中挥发出来的水蒸气)
【解析】(1)软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2),二氧化锰能够与浓盐酸反应生成氯化锰溶液、氯气和水,二氧化硅与盐酸不反应,所以剩余固体为二氧化硅;由于随着反应的进行浓盐酸变稀,稀盐酸与二氧化锰不反应,因此若有4mol浓盐酸参与反应,产生的氯气在标准状况下的体积小于22.4L,由于反应中还有氯化锰生成,则浓盐酸在该反应中表现出来的性质是酸性和还原性;(2)氯气溶于水:Cl2+H2O=HCl+HClO,HClO具有漂白性,能使有色布条褪色;(3)实验中观察到D中溶液变蓝色,说明有单质碘生成,即氯气将碘化钾氧化为单质碘,发生反应的离子方程式为2I-+Cl2=I2+2Cl-;(4)过量的铁和氯气反应后的固体,用磁铁除去过量的Fe,溶于水,加入KSCN溶液,溶液变红色,加入KMnO4溶液,溶液不褪色,铁和氯气反应与铁的量无关,反应生成氯化铁,因此氯气与Fe粉共热时发生反应的化学方程式为2Fe+3Cl2![]() 2FeCl3;(5)已知F中的产物易潮解,在F和H装置之间安装G装置,目的是防止H中的水蒸气进入到F装置中(或者吸收H中挥发出来的水蒸气)。
2FeCl3;(5)已知F中的产物易潮解,在F和H装置之间安装G装置,目的是防止H中的水蒸气进入到F装置中(或者吸收H中挥发出来的水蒸气)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】你认为下列说法不正确的是( )
A.氢键存在于分子之间,不存在于分子之内
B.对于组成和结构相似的分子,其范德华力随着相对分子质量的增大而增大
C.NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子
D.冰熔化时只破坏分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷雨天闪电时空气中有臭氧(O3)生成.下列说法正确的是( )
A.O2和O3互为同位素
B.O2转化为O3为化学变化
C.相同物质的量的O2和O3的体积相同
D.相同质量的O2和O3含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空:
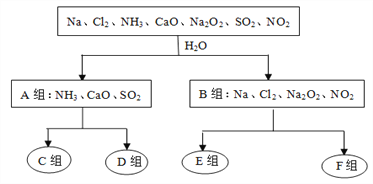
水溶液呈酸性 水溶液呈碱性 水作氧化剂 水既不作氧化剂也不作还原剂
(1)根据物质与水反应的情况,分成A、B组的分类依据是______________________________;
(2)A组中的CaO经常用作食品包装袋中的干燥剂,CaO所属的物质类别为____(填序号);
①金属氧化物 ②酸性氧化物 ③碱性氧化物 ④两性氧化物
(3)D组中的气体水溶液呈弱碱性,用电离方程式表示其水溶液呈弱碱性的原因:________________________________________________________________________________;
(4)F组中与水反应氧化剂与还原剂的之比是1:1的物质是______________(填化学式);
(5)SO2是形成酸雨的主要污染物,目前有一种较为有效的方法是在高空喷洒一种粉末状物质X,脱硫效果可达85%,其反应的化学方程式为:2X+2SO2+O2===2CaSO4+2CO2,由此可知X的化学式是_________;
(6)Cl2、Na2O2、SO2都能使品红褪色,其中漂白原理与其它两种物质不同的是_______________;将等物质的量的SO2、Cl2同时通入品红溶液中,实验现象是_________________________,产生该现象的原因是____________________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如表:
元素 | 相关信息 |
A | 原子核外L层电子数是K层的2倍 |
B | 其一种单质被称为地球生物的“保护伞” |
C | 元素的第一电离能是第3周期所有元素中最小的 |
D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
请回答下列问题:
(1)C在元素周期表中位于第周期、第族;D的基态原子核外电子排布式是 .
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同) , B、D的简单氢化物中稳定性较大的是 .
(3)B的常见单质和C的单质按物质的量比1:2反应生成的化合物中化学键的类型为;该化合物属于晶体.
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是 .
(5)已知:2AB(g)+B2(g)═2AB2(g)△H=﹣566.0kJmol﹣1
D(s)+B2(g)═DB2(g)△H=﹣296.0kJmol﹣1
处理含AB、DB2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质D,请写出此反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,元素的金属性和非金属性及其强弱比较与周期序数(n)和主族序数(A)有如下经验公式:K= ![]() (K为A与n的比值).下列推理正确的是( )
(K为A与n的比值).下列推理正确的是( )
A.当A一定时,K值越小,则元素的非金属性越强
B.当K=0,则该元素系同一周期中最活泼的金属元素
C.当n一定时,随着K值增大,则元素的非金属性逐渐增强
D.当K=l时,则该元素系过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N4分子结构为正四面体(如图所示)。已知:断裂N4(g)中1 molN-N键吸收193kJ能量,形成N2(g)中1 mol N![]() N放出941 kJ能量。下列说法正确的是
N放出941 kJ能量。下列说法正确的是
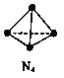
A. N4(g)比N2(g)更稳定
B. N4(g)=2N2(g) △H=+724kJmol-1
C. 形成1 mol N4(g)中的化学键放出193 kJ的能量
D. lmolN2(g)完全转化为N4(g),体系的能量增加362kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
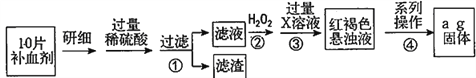
请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性无色透明溶液中,能大量共存的离子组是( )
A.NH4+、Mg2+、SO42—、Cl-B.K+、OH-、NO3—、Fe3+
C.Al3+、Cu2+、SO42—、Cl-D.Na+、Ca2+、Cl-、CO32—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com