
下列各组离子能大量共存的是
①“84”消毒液的水溶液中:Fe2+、Cl—、Ca2+、Na+
②加入KSCN显红色的溶液:K+、N 、Cl—、S2—
、Cl—、S2—
③能够与金属Cu常温下反应放出气体的溶液;Fe3+、Al3+、S 、K+
、K+
④pH=2的溶液中:N 、Na+、Cl—、Cu2+
、Na+、Cl—、Cu2+
⑤无色溶液中:K+、CH3COO—、HC 、Mn
、Mn
A.②③ B.①③ C.①⑤ D.③④
科目:高中化学 来源: 题型:
现有M、N、P、E 4种元素的单质,能发生以下反应:
①在水溶液中,M+N2+===M2++N ②P+2H2O(冷)===P(OH)2+H2↑ ③N、E相连浸入稀H2SO4中,电极反应为:N-2e-===N2+,2H++2e-===H2↑。判断它们的还原性由强到弱的顺序是( )
A.M、N、P、E B.P、M、N、E
C.M、N、E、P D.E、P、M、N
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,有下列三个热化学方程式:
(1)2H2(l)+O2(g)=== 2H2O(l) △H1= -Q1 kJ• mol-1
(2)2H2(g)+O2(g)=== 2H2O(l) △H1= -Q2 kJ• mol-1
(3)2H2(l)+O2(g)=== 2H2O(g) △H1= -Q3 kJ• mol-1
则Q1、Q2、Q3的关系表示正确的是( )
A. Q1=Q2<Q3 B. Q2 > Q1 >Q3 C. Q3> Q2> Q1 D. Q1=Q2=Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行下列反应:M (g)+N (g)  R (g)+2 L
R (g)+2 L
此反应符合右边图像。下列叙述正确的是( )

A.正反应吸热,L是气体 B.正反应吸热,L是固体
C.正反应放热,L是液体 D.正反应放热,L是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
在真空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应
PH4I(S)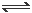 PH3(g) + HI(g) ① ;
PH3(g) + HI(g) ① ;
4PH3(g) 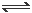 P4(g)+ 6 H2(g) ② ;
P4(g)+ 6 H2(g) ② ;
2HI(g)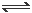 H2(g) + I2(g) ③
H2(g) + I2(g) ③
以上三反应建立平衡后,测得HI为b mol,I2(气)为c mol,H2为d mol。求:
⑴ 平衡后,容器内P4(气)和PH3的物质的量(用代数式表示):n(P4)= ,n(PH3)= 。
⑵ a,b,c三者的关系服从a > (填含b,c的代数式)。
⑶ 平衡后,增大压强,容器内n(I2) , n(PH4I) (增加、减少、不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
化学基本概念、化学用语是中学化学学习的重要内容之一。
I:氧化还原反应实际上包含氧化反应和还原反应两个过程,一个还原反应过程的离子方程式为:N +4H++3e-
+4H++3e- NO+2H2O。
NO+2H2O。
下列四种物质:KMnO4,Na2CO3,Na2SO3,Fe2(SO4)3中的一种物质甲,滴加少量稀硝酸,能使上述反应过程发生。
(1)被还原的元素是___________;还原剂是_________。
(2)写出并配平该氧化还原反应的离子方程式:_________________。
(3)若反应后,还原产物的化合价降低,而其他物质价态保持不变,则反应中氧化剂与还原剂的物质的量之比将_______(填“增大”“不变”减小”或“不能确定”)。
II:实验室需要用Na2CO3 l0H2O配制0.10mol/L Na2CO3溶液240mL。
l0H2O配制0.10mol/L Na2CO3溶液240mL。
按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、__________、___________。
(2)计算。
(3)称量。配制该溶液需称取Na2CO3 10H2O晶体_________g。
10H2O晶体_________g。
①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:

②称量过程中Na2CO3 10H2O晶体应放于天平的________(填“左盘”或“右盘”)。
10H2O晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是___________
(5)转移、洗涤。 (6)定容,摇匀。
若观察定容时液面情况如图所示,所配溶液的浓度会_________(填“偏高”、“偏低”或“无影响”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
可以由下列反应合成三聚氰胺:CaO+3C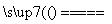 CaC2+CO↑,
CaC2+CO↑,
CaC2+N2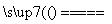 CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,
NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_____ ;CaCN2中阴离子为CN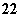 ,与CN
,与CN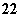 互为等电子体的
互为等电子体的
分子有N2O和________(填化学式),由此可以推知CN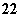 的空间构型为______ __。
的空间构型为______ __。
(2)尿素分子中C原子采取________杂化。
(3)三聚氰胺(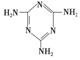 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (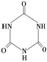 )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,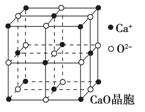 CaO晶体中Ca2+的配位数为 ,
CaO晶体中Ca2+的配位数为 ,
Ca2+采取的堆积方式为 ,
O2-处于Ca2+堆积形成的 空隙中;
CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是___________________________________。
(5)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应原理及其应用,不正确的是( )
A.苯与浓硝酸反应:制备TNT炸药
B.葡萄糖能与新制Cu(OH)2悬浊液反应:尿糖检测
C.醋酸能与CaCO3、Mg(OH)2等反应:用食醋除去暖水瓶中的水垢
D.乙烯和水反应生成乙醇:制取工业酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)分析下列物质的物理性质,判断其晶体类型。
A.碳化铝,黄色晶体,熔点2200 ℃,熔融态不导电________;
B.溴化铝,无色晶体,熔点98 ℃,熔融态不导电________;
C.五氟化钒,无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮中________;
D.溴化钾,无色晶体,熔融时或溶于水中都能导电________。
(2)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为________。
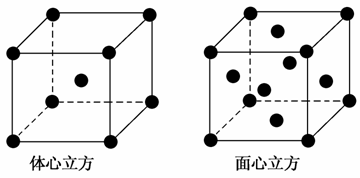
(3)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如上图所示。面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com