
【题目】将表面被氧化为Na2O、Na2O2的金属钠1.1g投入水中,收集到224mL气体(标准状况),该气体引爆后,冷却到原状态时,剩余气体为56mL。则Na、Na2O、Na2O2的质量分别为_____________克?
【答案】m(Na)=0.345g,m(Na2O2)=0.390g,m(Na2O)=0.365g或m(Na)=0.23g,m(Na2O2)= 0.78g,m(Na2O)=0.09g
【解析】
反应过程中涉及反应:2Na+2H2O=2NaOH+H2↑,Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑,2H2+O2![]() 2H2O,反应消耗气体为224mL-56mL=168mL,其中V(H2)=168×
2H2O,反应消耗气体为224mL-56mL=168mL,其中V(H2)=168×![]() =112mL,V(O2)=168×
=112mL,V(O2)=168×![]() =56mL,
=56mL,
①若剩余气体56mL为H2,则V(H2)=112mL+56mL=168mL,V(O2)=56mL,根据以上反应规律,进行相关物质的质量计算;
②若剩余气体56mL为O2,则V(H2)=112mL,V(O2)=56mL+56mL=112mL,根据以上反应规律,进行相关物质的质量计算。
反应过程中涉及反应:2Na+2H2O=2NaOH+H2↑,Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑,2H2+O2![]() 2H2O,反应消耗气体为224mL-56mL=168mL,其中V(H2)=168×
2H2O,反应消耗气体为224mL-56mL=168mL,其中V(H2)=168×![]() =112mL,V(O2)=168×
=112mL,V(O2)=168×![]() =56mL,
=56mL,
①若剩余气体56mL为H2,则V(H2)=112mL+56mL=168mL,V(O2)=56mL,n(Na)=2n(H2)=2×![]() =0.015mol,n(Na2O2)=2n(O2)=2×
=0.015mol,n(Na2O2)=2n(O2)=2×![]() =0.05mol,所以m(Na)=15×10-3mol×23g/mol=0.345g,m(Na2O2)= 5×10-3mol×78g/mol=0.390g,m(Na2O)=1.1g-0.345g-0.390g=0.365g;
=0.05mol,所以m(Na)=15×10-3mol×23g/mol=0.345g,m(Na2O2)= 5×10-3mol×78g/mol=0.390g,m(Na2O)=1.1g-0.345g-0.390g=0.365g;
②若剩余气体56mL为O2,则V(H2)=112mL,V(O2)=56mL+56mL=112mL,n(Na)=2n(H2)=2×![]() =0.01mol,n(Na2O2)=2n(O2)=2×
=0.01mol,n(Na2O2)=2n(O2)=2×![]() =0.01mol,所以m(Na)=10×10-3mol×23g/mol=0.23g,m(Na2O2)=10×10-3mol×78g/mol=0.78g,m(Na2O)=1.1g-0.23g-0.78g=0.09g。
=0.01mol,所以m(Na)=10×10-3mol×23g/mol=0.23g,m(Na2O2)=10×10-3mol×78g/mol=0.78g,m(Na2O)=1.1g-0.23g-0.78g=0.09g。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z为元素周期表中的短周期元素,它们在周期表中的位置关系如图所示,下列推断正确的是
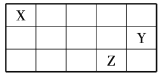
A.无法推断出X、Y、Z的具体元素
B.Y可能是F元素
C.Z的最高价氧化物对应水化物的酸性比Y的强
D.X、Y两种元素形成的最简单化合物比X、Z形成的最简单化合物稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W,原子序数依次增大,请结合表中信息回答下列问题。
字母代号 | X | Y | Z | W |
结构或性质 | X的最高价氧化物对应的水化物与其气态氢化物反应可得到一种盐 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,Z的离子半径最小 | 原子核外最外层电子数是次外层电子数的一半 |
(1)W在元素周期表中的位置为_________。
(2)四种元素的最高价氧化物对应的水化物中,有一种物质与其他三种物质在一定条件下均能发生化学反应,该元素是_____(填元素名称)。
(3)X元素的最高价氧化物对应的水化物与其气态氢化物反应得到的化合物为____(填化学式)。
(4)向含有Z元素的简单阳离子的溶液中加入过量的NaOH溶液,发生反应的离子方程式为______________。
(5)下列可用来判断Z和Mg的金属性强弱的方法是_____(填序号)。
a.测量两种元素单质的硬度和熔、沸点
b.比较单质与同浓度盐酸反应的剧烈程度
c.比较两种元素在化合物中化合价的高低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是
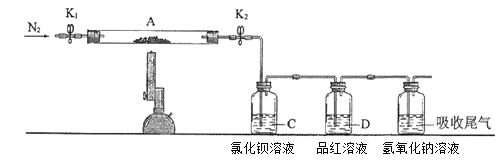
A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应C(s) + CO2(g)![]() 2CO(g) △H>0,达到平衡状态,进行如下操作:
2CO(g) △H>0,达到平衡状态,进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量;
③缩小反应体系的体积; ④减少体系中CO的量。
上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④B.①③C.①②D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2 g H2O。下列说法正确的是
A. 该化合物仅含碳、氢两种元素 B. 该化合物中碳、氢原子个数比为1:4
C. 无法确定该化合物是否含有氧元素 D. 该化合物一定是C2H8O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列几组物质,请将序号填入下列空格内:A.CH2=CH-COOH和油酸(C17H33COOH) B.12C60和石墨 C.![]() 和
和![]() D.35Cl和37Cl E.乙醇和乙二醇
D.35Cl和37Cl E.乙醇和乙二醇
①互为同位素的是____________;
②互为同系物的是_________;
③互为同素异形体的是__________;
④互为同分异构体的是_____________;
⑤既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是______。
(2)请写出下列反应的化学方程式:
①由丙烯制取聚丙烯:________。
②丙氨酸缩聚形成多肽:_______。
③淀粉水解:__________。
④丙醛与新制的氢氧化铜悬浊液反应:_________。
(3)某烃经李比希元素分析实验测得碳的质量分数为83.3%,氢的质量分数为16.7%,其相对分子质量为72,该烃的核磁共振氢谱如图所示,请通过计算确定该烃的分子式__________,结构简式____________。
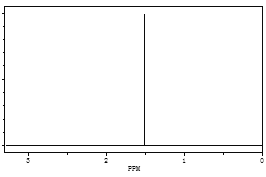
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种物质:①CH3COOH ②CH2=CH2 ③![]() ④CH3OH
④CH3OH
(1)官能团的名称是①_____;②_____;③_____;④_____。
(2)②使溴水褪色的化学方程式为_____。
(3)③转化成2-丙醇的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:4HCl(g)+O2(g)═2Cl2(g)+2H2O(g),一定条件下测得反应过程中n(Cl2)与时间的关系如表所示:则4~6min内用O2的物质的量变化表示的反应速率是( )
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
n(Cl2)/mol | 0 | 1.2 | 2.6 | 4.4 | 5.4 | 6.0 |
A.7.2molmin-1B.8.0molmin-1C.0.9molmin-1D.0.45molmin-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com