
 如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题.
如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题.
| ||
| ||


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| A、N2电子式:N:::N: |
| B、HCl电子式H:Cl |
| C、乙烯的结构简式:CH2=CH2 |
| D、聚丙烯的结构简式:[CH3-CH2-CH2]n |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知HF的共价键键能比HCl大,说明稳定性:HF>HCl | ||||
| B、已知正反应的活化能大于逆反应的活化能,说明总能量:生成物>反应物 | ||||
| C、已知NaClO+SO2+H2O→HClO+Na2SO3,说明给出质子能力:HSO3->HClO | ||||
D、已知CaCO3+SiO2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、T℃时,两饱和溶液中c(Ca2+):CaCO3>CaF2 |
| B、T℃时,两饱和溶液等体积混合,会析出CaF2固体 |
| C、T℃时,CaF2固体在稀盐酸中的Ksp比在纯水中的Ksp大 |
| D、T℃时,向CaCO3悬浊液中加NaF固体,可能析出CaF2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;x2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号或化学式表示):
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;x2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号或化学式表示):查看答案和解析>>
科目:高中化学 来源: 题型:
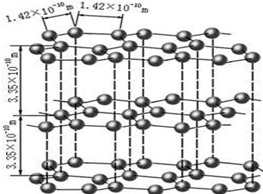
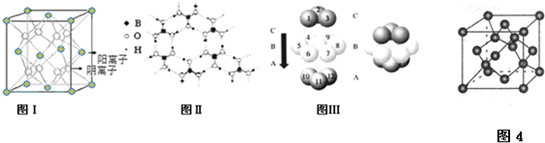
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | C-H | C=C | C-C | H-H |
| 键能/kJ?mol-1 | 414.4 | 615.3 | 347.4 | 435.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 编号 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com