
| A、0.1mol?L-1 CH3COONa溶液与0.1mol?L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | ||
| B、0.1mol?L-1 NH4Cl溶液与0.1mol?L-1氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl-)>c(OH-) | ||
C、0.1mol?L-1 Na2CO3溶液与0.1mol?L-1 NaHCO3溶液等体积混合:
| ||
| D、0.1mol?L-1 Na2C2O4溶液与0.1mol?L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
| 2 |
| 3 |


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属原子的核外电子在金属晶体中都是自由电子 |
| B、镁型和铜型的原子堆积方式空间利用率最高 |
| C、金属原子在化学变化中失去的电子数越多,其还原性越强 |
| D、金属导电的实质是金属阳离子在外电场作用下的定向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中导电粒子的数目减少 |
| B、再加入10mLpH=11的NaOH溶液,混合液的pH=7 |
| C、溶液中c(OH-)增大 |
| D、醋酸的电离程度增大,c(H+)亦增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径的大小顺序为W>Q>Z>X>Y |
| B、元素X的气态氢化物与Q的单质可发生置换反应 |
| C、元素X与Y可以形成5种以上的化合物 |
| D、元素Z、W、Q的单质在一定条件下均能和强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素的性质随着原子序数的递增而呈周期性变化 |
| B、随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现 |
| C、随着元素原子序数的递增,元素的最高化合价从+1到+7,最低化合价从-7到-1重复出现 |
| D、元素性质的周期性变化是指相对原子量的周期性变化、原子半径的周期性变化及元素主要化合价的周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
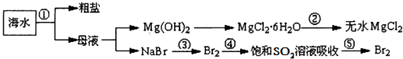
| A、第②步是MgCl2?6H2O在坩埚中加强热分解 |
| B、第①步是海水蒸发浓缩、结晶过滤 |
| C、第③、⑤步可以是通入足量Cl2 |
| D、在第④步反应为:Br2+SO2+2H2O=H2SO4+2HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol/L |
| B、2mol/L |
| C、3 mol/L |
| D、4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
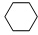 (g)
(g)| Pt-Sn/Al2O3 |
| 高温 |
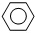 (g)+3H2(g)
(g)+3H2(g)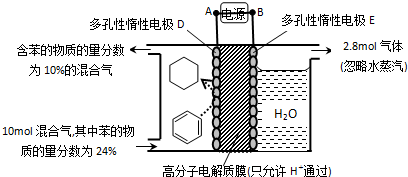
| 生成目标产物消耗的电子数 |
| 转移的电子总数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com