
(07年宁夏卷)(14分)(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应:_____________ ;
银片上发生的电极反应:______________ 。
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,试计算:
①产生氢气的体积(标准状况);
②通过导线的电量。(已知NA=6.02×1023/mol,电子电荷为1.60×10-19C)
答案:(1)Zn-2e-=Zn2+ 2H++2e-=H2↑ (2)①4.5L ②3.8×104C
解析: (1)因金属的活动性顺序为Zn>Ag,所以将锌片和银片浸入稀硫酸中组成原电池时,锌片作负极,发生氧化反应:
Zn-2e-=Zn2+;银片作正极,发生还原反应2H++2e-=H2↑ 。(2)①根据电极反应,知锌片与银片减少的质量等与生成氢气所消耗
的锌的质量,设产生的氢气的体积为x。
Zn + 2H+ = Zn2+ + H2↑
65g 22.4L60g-47g x
所以 ,解得 x=4.5L。
,解得 x=4.5L。
②反应消耗的锌的物质的量为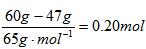 ,因为锌发生氧化反应时 Zn-2e-=Zn2+ ,所以通过导线的电量为0.20mol×2×6.02×1023mol-1×1.60×10-19C=3.8×104C。
,因为锌发生氧化反应时 Zn-2e-=Zn2+ ,所以通过导线的电量为0.20mol×2×6.02×1023mol-1×1.60×10-19C=3.8×104C。
高考考点:原电池、电极反应式的书写、化学计算。
易错提醒:计算题的格式掌握不熟练而导致出错而扣分;审题不清将电量求成电子的物质的量。
备考提示:电化学知识是化学理论部分的一个重要内容,也是历年高考命题的热点之一。电化学知识既可以是综合学科内知识如联系到“化学实验现象的判断和分析、定量实验的操作要求、离子方程式的书写、氧化还原反应问题分析、化学计算”等,也可以涉及学科间知识的运用,如联系到物理学科的“电流强度的计算、电量的计算、电路的连接”等,还可以与生产生活(如金属的腐蚀与防护、电镀等)、新科学及新技术(如新型电池)等问题相联系,是不可忽视的一个重点知识点。在备考复习中要引起足够的重视。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(07年宁夏卷)若NA表示阿佛加德罗常数,下列说法正确的是()
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0℃,101kPa时,22.4L氢气中含有NA个氢原子
C.14g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol 甲烷的质量比为74
查看答案和解析>>
科目:高中化学 来源: 题型:
(07年宁夏卷)若NA表示阿佛加德罗常数,下列说法正确的是()
A.1 mol Cl2 作为氧化剂得到的电子数为NA
B.在0℃,101kPa时,22.4L氢气中含有NA个氢原子
C.14g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol 甲烷的质量比为74
查看答案和解析>>
科目:高中化学 来源: 题型:
(07年宁夏卷)(15分)以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平
实验步骤:
① 准确称量一个干净、干燥的坩埚;
② 在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量的试样放入研钵中研细,再放回到坩埚中;
③ 将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④ 将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤ 将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥ 根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是 ____________ ;
(2)指出实验步骤中存在的错误并改正:______________ ;
(3)硫酸钠不能放置在空气中冷却的原因是__________________ ;
(4)步骤⑤的目的是 _______________ ;
(5)下面的情况有可能造成测试结果偏高的是___________ (填序号)。
A.试样中含有加热不挥发的杂质
B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水
D.实验前坩埚未完全干燥
E.晶体加热脱水不完全
F.加热时有晶体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
(07年宁夏卷)(15分)以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平
实验步骤:
① 准确称量一个干净、干燥的坩埚;
② 在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量的试样放入研钵中研细,再放回到坩埚中;
③ 将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④ 将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤ 将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥ 根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是_________ ;
(2)指出实验步骤中存在的错误并改正:_____________________ ;
(3)硫酸钠不能放置在空气中冷却的原因是 ____________________ ;
(4)步骤⑤的目的是__________________ ;
(5)下面的情况有可能造成测试结果偏高的是__________(填序号)。
A.试样中含有加热不挥发的杂质
B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水
D.实验前坩埚未完全干燥
E.晶体加热脱水不完全
F.加热时有晶体溅出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com