
【题目】(19分)Ⅰ.实验室配制物质的量浓度均为0.2mol/L 的NaCl溶液和稀H2SO4 各480mL.提供的试剂是:NaCl固体和98%的浓H2SO4(密度为1.84g/cm3)及蒸馏水.
(1)应用托盘天平称量NaCl g,应用10mL量筒量取H2SO4 mL;
(2)配制两种溶液时都需要的仪器是 ;
(3)稀释浓H2SO4时应注意 ;
(4)在配制上述溶液实验中,下列操作引起结果偏低的有 (填序号)
A、在烧杯中溶解溶质搅拌时,溅出少量溶液
B、没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
C、定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D、将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E、把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
F、容量瓶刚用蒸馏水洗净,没有烘干
G、量筒量取浓H2SO4后没有用蒸馏水洗涤2~3次,并将洗液移入容量瓶中.
H、容量瓶加水定容时俯视刻度线
Ⅱ.为了测定已部分变质的过氧化钠样品的纯度(质量百分含量),设计如图所示的实验装置,图中Q为弹性良好的气球(不与药品反应),称取一定量的样品放入其中。按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中。

请回答下列问题:
(1)Q内发生反应生成________种气体,其中的反应有________个为氧化还原反应。
(2)为测定反应时生成气体的总体积,滴稀H2SO4前必须关闭________(填“K1”、“K2”或“K3”),打开______(填“K1”、“K2”或“K3”)。
(3)当上述反应停止时,将K1、K2、K3均关闭,然后先打开K2,再缓缓打开K1,这时可观察到的现象是 。
(4)b中装的固体试剂是__________,需缓缓打开K1的原因为 。
(5)实验结束时,量筒Ⅰ中有x mL水,量筒Ⅱ中收集到y mL气体,则过氧化钠的纯度是 (用含x、y的式子表示,上述体积均已折算成标准状况)。
【答案】
Ⅰ.(8分)(1)5.9 5.4 mL;
(2)烧杯、玻璃棒、500ml容量瓶、胶头滴管;
(3将浓硫酸沿烧杯内壁注入水中,边加边用玻璃棒搅拌;
(4) ABCE
Ⅱ.(11分)(1)2 1;
(2)K1、K2 K3;
(3)气球Q慢慢变小,气体进入量筒Ⅱ中
(4)碱石灰(其他合理答案也可以);控制气体的流速,使CO2被充分吸收
(5)![]() ×100%
×100%
【解析】
试题分析:Ⅰ.(1)配制480mL0.2mol/L的NaCl溶液,应选择500mL容量瓶,需要溶质的质量m=0.2mol/L×58.5g/mol×0.5L=5.9g;98%的浓H2SO4(密度为1.84g/cm3)的物质的量浓度C=![]() =18.4mol/L,配制480mL0.2mol/L 的稀H2SO4,应选择500mL容量瓶,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得:0.2mol/L×0.5L=18.4mol/L×V,解得V=0.0054L,即5.4mL;故答案为:5.9 5.4 mL;
=18.4mol/L,配制480mL0.2mol/L 的稀H2SO4,应选择500mL容量瓶,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得:0.2mol/L×0.5L=18.4mol/L×V,解得V=0.0054L,即5.4mL;故答案为:5.9 5.4 mL;
(2)配制NaCl溶液的步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶,用到的仪器是:托盘天平、烧杯、玻璃棒、500ml容量瓶、胶头滴管;配制稀H2SO4的步骤是计算、量取、稀释、洗涤、定容、摇匀、装瓶,用到的仪器是:量筒、烧杯、玻璃棒、500ml容量瓶、胶头滴管;配制两种溶液时都需要仪器:烧杯、玻璃棒、500ml容量瓶、胶头滴管;故答案为:烧杯、玻璃棒、500ml容量瓶、胶头滴管;
(3)由于浓硫酸密度大、溶于水放热,故稀释浓硫酸的方法:将浓硫酸沿烧杯内壁注入水中,边倒边用玻璃棒搅拌;故答案为:将浓硫酸沿烧杯内壁注入水中,边倒边用玻璃棒搅拌;
(4)A、在烧杯中溶解溶质搅拌时,溅出少量溶液,导致溶质的物质的量偏低,溶液浓度偏低,故A选;B、没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中,导致溶质的物质的量偏低,溶液浓度偏低,故B选;C、定容时,加水超过了刻度线,倒出一些再重新加水到刻度线,导致溶质的物质的量偏低,溶液浓度偏低,故C选;D、将所配溶液从容量瓶转移到试剂瓶时,有少量溅出,导致溶质的物质的量偏低,溶液浓度偏低,故D选;E、把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用,溶液稀释,溶液浓度降低,故E选;F、容量瓶刚用蒸馏水洗净,没有烘干,对溶质的物质的量和溶液的体积都不产生影响,溶液浓度不变,故F不选;G、量筒量取浓H2SO4后没有用蒸馏水洗涤2~3次,并将洗液移入容量瓶中,量取的浓硫酸物质的量偏大,溶液浓度偏高,故不选;故选:ABCDE
Ⅱ.(1)变质的过氧化钠中含有碳酸钠,加入酸后Q内发生反应:2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑;Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,前者的氧元素的化合价发生了变化,是氧化还原反应,后者元素的化合价未变,是非氧化还原反应,故答案为:2;1;
(2)反应产生的CO2、O2使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的CO2、O2的体积,所以滴稀H2SO4前必须关闭K1、K2打开K3,故答案为:K1、K2;K3;
(3)反应停止,打开K2,再缓缓打开K1,广口瓶内外相通,气球Q慢慢缩小,故答案为:气球Q慢慢缩小;
(4)混合气体通过碱石灰吸收CO2,最后量筒Ⅱ中收集的是O2,故答案为:碱石灰;控制气体流速,使CO2充分吸收;
(5)2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑; Na2CO3 +H2SO4=Na2SO4+H2O+CO2↑,
![]() ×2
×2 ![]()
![]()
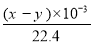
则过氧化钠的质量为:![]() ×2×78,碳酸钠的质量为:
×2×78,碳酸钠的质量为:![]() ×106,所以过氧化钠的纯度:
×106,所以过氧化钠的纯度:![]() =
=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl- 六种粒子。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是

A. 该反应的还原剂是Cl-
B. 消耗1 mol还原剂,转移6 mol电子
C. 氧化剂与还原剂的物质的量之比为2:3
D. 反应后溶液的酸性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的应用的说法正确的是
A.金属活泼性铜比铁弱.可在铁船闸上装铜块减缓其腐蚀
B.MgO的熔点很高,可用于制作耐高温材科
C.铝能置换出氧化铁中的铁,可用于钢铁工业中大量冶炼铁
D.二氧化硫有漂白、杀菌性能,可在食品生产中大量使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10﹣2,K2=5.4×10﹣5.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解为CO、CO2和H2O。回答下列问题:

(1)写出草酸晶体分解的化学方程式_________________________________。
(2)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。若实验过程中,B中澄清石灰水变浑浊,______(填“能”或“不能”)说明草酸晶体的分解产物中有CO2,原因是______。
(3)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A和如图所示的部分装置(可以重复选用)进行实验。

①乙组同学的实验装置中,依次连接的合理顺序为A →___→____→G→ →____。装置H反应管中盛有的物质是 。
②F装置的作用是___________________________________。
③能证明草酸晶体分解产物中有CO的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制备,其中a中加乙醇、乙酸和浓硫酸,在试管b中加入7mL饱和碳酸钠溶液。连接好装置。用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。回答下列问题:

(1)a中配置混合溶液时,加入试剂的正确顺序是_______(填“A”或“B”);
A.先加入2mL浓硫酸,再慢慢注入2mL乙醇和3mL乙酸
B.先加入2mL乙醇,再慢慢注入2mL浓硫酸和3mL无水乙酸
(2)写出a试管中的主要化学反应的方程式:____________________________。
(3)加入浓H2SO4的目的是_____________________。
(4)在实验中球形干燥管除起冷凝作用外,另一个重要作用是_______。
(5)若要将b试管中的乙酸乙酯分离出来,应采用的实验操作是______________(填操作名称);
(6)将1mol 乙醇(其中的氧用 18O 标记)在浓硫酸存在条件下与足量乙酸充分反应。下列叙述不正确的是_______。
A.生成的乙酸乙酯中含有18O
B.生成的水分子中含有18O
C.可能生成 44g 乙酸乙酯
D.不可能生成 90g 乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一次性电池——铜锌电池的简易装置。

(1)该电池的负极材料是 ;在外电路中,电流方向是 。
(2)正极上发生 (填“氧化”或“还原”)反应,正极反应式是 。
(3)锂离子电池是新一代可充电的绿色电池,其必须采用非水电解质或固体电解质的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题。

(1)仪器a的名称为________;仪器b中可选择的试剂为________。
(2)实验室中,利用装置A,还可制取的无色气体是________(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管中有无色无味的气体产生,上述现象证明NH3具有________性,写出相应的化学方程_ 。
(4)装置E中浓硫酸的作用是_______________________。
(5)读取气体体积前,应对装置F进行的操作:_____________________。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比值为________(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
(1)若反应的乙醇中O为18O,用同位素示踪法写出制取乙酸乙酯的化学反应方程式:
。
(2)浓硫酸的作用是:① ;② 。
(3)该装置中有一个明显的错误是 。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(5)某同学将收集到的乙酸乙酯滴入饱和NaHCO3溶液中,观察到有少量气泡产生,可得出的结论是 ,该过程中发生反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以烃的含氧衍生物X为主要原料生产可降解塑料PCL{![]() }及阻燃剂四溴双酚A。合成线路如下:
}及阻燃剂四溴双酚A。合成线路如下:

已知:① X的蒸汽密度是相同条件下H2的47倍,遇FeCl3溶液显紫色;C为![]()
![]()
![]()
(1)X的分子式为_______________;B的名称是_________________。
(2)B→C还需要的反应试剂及条件是____________。C→D的反应类型是_______。
(3)写出X→Y的化学方程式:_________________________________。
(4)0.5mol四溴双酚A在一定条件下与足量的NaOH溶液反应,最多消耗_________molNaOH。
(5)符合以下条件的D的同分异构体有_________种(不考虑空间异构)。
①含有两个甲基和两种官能团②能使溴的CCl4溶液褪色③能发生银镜反应
(6)已知由烯烃直接制备不饱和酯的新方法为:
![]()
利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料![]() ,写出合成该涂料的反应流程图:______________________________________________。
,写出合成该涂料的反应流程图:______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com