
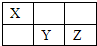
 X、Y、Z均为短周期元素,它们在周期表中的相对位置如图所示.已知X、Y、Z三元素的质子数之和为40,请回答:
X、Y、Z均为短周期元素,它们在周期表中的相对位置如图所示.已知X、Y、Z三元素的质子数之和为40,请回答:分析 X、Y、Z均为短周期元素,三元素的质子数之和为40,由元素在周期表中的相对位置,可知X在第二周期,Y、Z在第三周期,令X的质子数为a,则Y的质子数为a+9,Z的质子数为a+10,所以a+a+9+a+10=40,解得a=7,即X为N元素、Y为S元素、Z为Cl元素.
解答 解:(1)X、Y、Z均为短周期元素,三元素的质子数之和为40,由元素在周期表中的相对位置,可知X在第二周期,Y、Z在第三周期,令X的质子数为a,则Y的质子数为a+9,Z的质子数为a+10,所以a+a+9+a+10=40,解得a=7,即X为N元素、Y为S元素、Z为Cl元素,.
故答案为:N;S;Cl;
(2)Y为S元素,原子核外有3个电子层,最外层电子数为6,处于周期表中第三周期VIA族,
故答案为:第三周期VIA族.
点评 本题考查元素周期表及应用,注意理解掌握同主族元素原子序数关系,注意基础知识积累掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 通过测同温同浓度下的Na2CO3和Na2SO3水溶液的pH可以确定碳和硫两元素非金属性强弱 | |
| B. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| C. | Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性,后者表现出漂白性 | |
| D. | 总质量一定时,甲醛和乙酸无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子排布式1s22s22p63s23p64s3违反了泡利原理 | |
| B. | 基态原子电子排布式1s22s22p63s23p63d5违反了能量最低原理 | |
| C. | 根据构造原理,原子核外电子填充顺序为1s2s2p3s3p4s3d4p5s5p4d6s4f5d6p | |
| D. | 某主族元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应的发生都需要加热,吸热反应都没有利用价值 | |
| B. | 若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应 | |
| C. | 放热反应放出热量的多少与反应物的质量和状态有关 | |
| D. | 不管是吸热反应还是放热反应,升高温度,反应速率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 ml、1 mol•L-1 硝酸钠溶液 | B. | 75 ml、2.5 mol•L-1硝酸钙溶液 | ||
| C. | 150 ml、3 mol•L-1 硝酸钾溶液 | D. | 50 ml、3 mol•L-1硝酸镁溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com