
����Ŀ��A��B��C��D��E��FΪ��ѧ��ѧ�еij������ʣ�������A��1��2�ֶ�����Ԫ����ɣ���һ��������������ת����ϵ��������������⣺
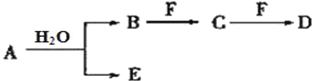
��1����������AΪ��ɫ���壮
�ٵ�F��һ�ֽ�������ʱ��һ��Ũ�ȵ�B��Һ������F��Ӧ����C������E����F���B��Һ��Ӧ�����ӷ���ʽ______________________________________________
�ڵ�C��һ�ֲ�������ЧӦ���������ʱ��E����Ư���ԣ�����F��ɫ��Ӧ�ʻ�ɫ��д��C��F��Һ����D�Ļ�ѧ����ʽ______________________________________��
��2����AΪ����ɫ���壬DΪ��ɫ������ˮ�����ʣ���A��D��ʽ����ȣ���A��D�н���Ԫ�ص�����������ˮ����ļ���ǿ��˳��Ϊ__________________���û�ѧʽ��ʾ��
��3����A��һ��Ԫ��ԭ�ӵ�����������Ϊ�ڲ����������1/5��FΪһ�ֳ��������嵥�ʣ���B��D�ֱ�����ˮ��������Һ��ǡ��������ϵ�һ�ֲ�������Ԫ�ص�����Һ����д��A��H2O��Ӧ�Ļ�ѧ����ʽ��____________________________��
���𰸡� Fe��4H����NO3��=Fe3����NO����2H2O CO2+Na2CO3+H2O��2NaHCO3 NaOH > Al(OH)3 Mg3N2��6H2O=3Mg(OH)2����2NH3��
����������1��A����ɫ���壬��ѧ��ѧ������Cl2��NO2��O3��A����ˮ��Ӧ�ų������Ŀ����ԣ��ټ���AΪ��������BΪ��HCl��E��HClO��F�ǽ������ʣ������ᷴӦ���ɽ����Ȼ�������������������У���A������������Ӧ��NO2�������Ƴ�B��HNO3��E��NO��������F��Ӧ˵��F�DZ�۽�������۽��������ᷴӦ�������������̬�ģ���F��Fe��C��Fe(NO3)3��D��Fe(NO3)2��B��F�����ӷ���ʽ��Fe��4H����NO3��=Fe3����NO����2H2O����C�Dz�������ЧӦ�ĵ����壬��C��CO2������F����ɫ��Ӧ�ʻ�ɫ��˵������Ԫ�أ�E����Ư���ԣ����ݢٵķ�����AΪCl2��BΪ��HCl��E��HClO��F��Na2CO3��D��NaHCO3����C��F��Һ����D�Ļ�ѧ����ʽCO2+Na2CO3+H2O��2NaHCO3����2��AΪ����ɫ���壬���ܺ�ˮ��Ӧ���Ƴ�A��Na2O2��E��O2��B��NaOH��A��D��Ħ��������ȣ���DΪ��ɫ������ˮ�����ʣ���D��Al(OH)3��F��AlCl3��C��NaAlO2�����A��D�н���Ԫ�ص�����������ˮ����ļ���ǿ��˳��ΪNaOH > Al(OH)3����3��A��һ��Ԫ��ԭ�ӵ�����������Ϊ�ڲ����������1/5����A�ɶ�����Ԫ����ɣ��Ƴ�A������Ԫ��Ӧ�ǵ�������Ԫ�أ���MgԪ�أ�B��D�õ�һ�ֲ�������Ԫ�ص�����Һ���ó�����������Σ����A��Mg3N2��B��NH3��E��Mg(OH)2��F��O2��C��NO��D��NO2��Mg3N2��ˮ������Ӧ�ķ���ʽΪ��Mg3N2��6H2O=3Mg(OH)2����2NH3����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe3O4����Ҫ�Ļ�ѧ�Լ����仯ѧʽ�����Ա�ʾΪFeO��Fe2O3��������������ȼ������ȡ����Ϊ�����Ϳ�ݵķ�����ͼ1����ȡ������������ϵ��װ�ã�Aװ��������ȡ������̼���壬��Ҫ�������ȶ������ٿɿء�
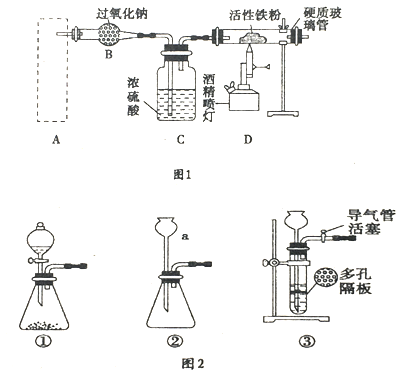
��1��ͼ2������a��������_____________________��
��2��������ĿҪ����ͼ2�����ѡ��_____________������ţ���ΪAװ�á�
��3����ͼ2��װ�âڽ��������Լ��ķ�����__________________________��
��4����Bװ���з�������Ҫ��Ӧ�Ļ�ѧ����ʽ��___________________________��
��5����Ӧһ��ʱ�������Ӳ�ʲ������еĹ����ĩ�������ܽ⣬ȡ������Һ���Թ��У�������۵⻯����Һ��û����ɫ���֣��Ʋ�����ĩ�г�Fe3O4�⣬һ����____________�������ƣ���
��6��д��Fe3O4��������ϡ��������ӷ���ʽ_______________��Ҫ����������Һ�е�Fe3+�������Լ���____________�������ƣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��N2(g)+3H2(g)![]() 2NH3(g)����H����94.4kJ��mol-1������ʱ����ϵ�и�����Ũ����ʱ��仯��������ͼ��ʾ��
2NH3(g)����H����94.4kJ��mol-1������ʱ����ϵ�и�����Ũ����ʱ��仯��������ͼ��ʾ��
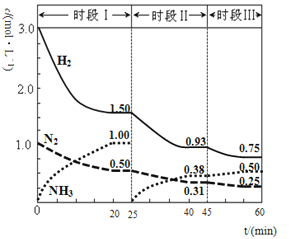
����1L�����з�����Ӧ��ǰ20min�ڣ�v(NH3)��______���ų�������Ϊ________��
��25minʱ��ȡ�Ĵ�ʩ��_______��
��ʱ���������£���Ӧ��ƽ�ⳣ������ʽΪ____���þ������ݱ�ʾ������λ����
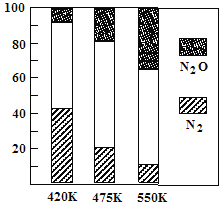
��2���糧�����ѵ�������Ӧ�٣� 4NH3(g)��6NO(g)![]() 5N2(g)��6H2O(g)������Ӧ�ڣ� 2NH3(g)��8NO(g)
5N2(g)��6H2O(g)������Ӧ�ڣ� 2NH3(g)��8NO(g)![]() 5N2O(g)��3H2O(g)����H��0��ƽ��������N2��N2O�������¶ȵĹ�ϵ��ͼ����ش���400K��600Kʱ��ƽ��������N2�������¶ȵı仯������________
5N2O(g)��3H2O(g)����H��0��ƽ��������N2��N2O�������¶ȵĹ�ϵ��ͼ����ش���400K��600Kʱ��ƽ��������N2�������¶ȵı仯������________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��H��Ϊ���л�ѧ���������ʣ�����֮��Ĺ�ϵ��ͼ��ʾ����������ʾ���ڵ����������ܷ�����Ӧ����������ʾת����ϵ�����ַ�Ӧ�ķ�Ӧ�������ͷ�Ӧ����δ�����������A��������Ԫ����ɵĻ����B��E�ǽ����������B�Ǻ�ɫ�����ĩ��C��ʵ���ҳ���������G����ش��������⣺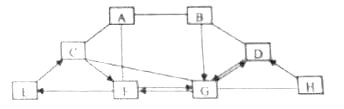
��1��D�Ļ�ѧʽ�� ��
��2��д������G��һ����; ��
��3�����H��Ԫ�����γɶ��ֵ��ʣ���д���γɵ���ɫ���ʵ����� ��
��4��д��A��F��Ӧ�Ļ�ѧ����ʽ �� �÷�Ӧ�������������Ӧ���ͣ���
��5��д��C��G��Ӧ�Ļ�ѧ����ʽ ��
��6��E��C��Ӧ��������ų��������ա�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���д������
A. ��������ͬ��ԭ�ӣ����������Ų�Ҳ��ͬ
B. ��������ͬ��ԭ�ӣ��仯ѧ����һ����ͬ
C. ������Խ���ã���ԭ���ڷ�Ӧ��Խ��ʧȥ����
D. �ǽ�����Խ���ã���������Խ��ʧȥ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�������DZ�̼�ỹ�����ᣬ��ӦCl2+H2OHCl+HClO�ﵽƽ���ҪʹHClOŨ�����ɼ��루������
A. NaCl���� B. CaCO3���� C. ˮ D. NaOH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ�У���ֱ�ӱ�ʾ���Ȼ��ƾ����ܵ���(����)
A.Na��(g)��Cl��(g)===NaCl(s)����H1B.Na(s)��Cl(g)===NaCl(s)����H2
C.Na��(g)��Cl��(g)===NaCl(g)����H3D.Na(g)��Cl(g)===NaCl(s)����H4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ2KMnO4+16HCl(Ũ)=2KCl+2MnCl2+5Cl2��+8H2O�У���������
A. KMnO4B. HClC. MnCl2D. Cl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ͬѧд���ĸ���ѧ��Ӧ����ʽ��ע���ķ�Ӧ���ͣ����ж�Ӧ����ȷ���ǣ� ��
A.C+O2![]() CO2���Ϸ�Ӧ
CO2���Ϸ�Ӧ
B.2H2O2![]() 2H2O+O2���ֽⷴӦ
2H2O+O2���ֽⷴӦ
C.KCl+AgNO3=AgCl��+KNO3���ֽⷴӦ
D.3CO+Fe2O3![]() 2Fe+3CO2�û���Ӧ
2Fe+3CO2�û���Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com