
| [CO] | [CO2] |
| [CO2]3 |
| [CO]3 |
| m |
| M |
| 3 |
| 2 |
| [CO] |
| [CO2] |
| [CO2]3 |
| [CO]3 |
| [CO2]3 |
| [CO]3 |
| m |
| M |
| 11.2g |
| 56g/mol |
| 3 |
| 2 |
| 0.3mol |
| 2L |
| 0.15mol/L |
| 5min |
| [CO] |
| [CO2] |
| 6.4×10-53 |


科目:高中化学 来源: 题型:
| 元素 | 元素性质及相关信息 |
| A | 其单质的一种晶体虽不是金属晶体,但是电的良导体,且难熔、质软并有润滑性,可作高温轴承的润滑剂、火箭发动机喷管和电极材料. |
| B | 其单质能与强酸、强碱溶液反应,其离子在第三周期单核阳离子中半径最小. |
| C | 是蛋白质的组成元素之一,原子核外有3种不同能量的电子,且未成对电子数最多. |
| D | 原子核外最外层电子排布为nsnnp2n+1. |


 NH 3?H2O
NH 3?H2O NH4++OH-
NH4++OH- NH 3?H2O
NH 3?H2O NH4++OH-
NH4++OH-查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2010年四川绵阳高考预测(综合题)化学卷 题型:填空题
(16分)金属单质及其化合物与工农业生产、日常生活有密切的联系。请回答下列问题:
(2)一定温度下,氧化铁可以与一氧化碳发生如下反应:
①该温度时,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,5 min后,生成了单质铁11.2 g,则这段时间内CO的反应速率为 ;
②达平衡后,若温度升高,的值增大,则Q 0(填“>”、“=”、“<”)。
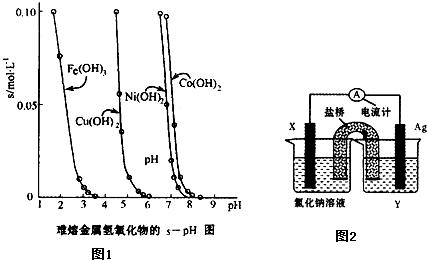
(3)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的。如是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol·L-1)。若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为 (填序号)。 
A.小于l B.4左右 C.大于6 D.大于9
(4)某工业废水中含有Cu2+、Pb2+、Hg2+,若向工业废水中加入过量的FeS,当FeS、CuS、PbS和HgS共存时,溶液中c(Fe2+):c(Pb2+):c(Hg2+)= : : 。
已知:Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(PbS)=3.4×10-28mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2,Ksp(HgS)=6.4×10-53mol2·L-2
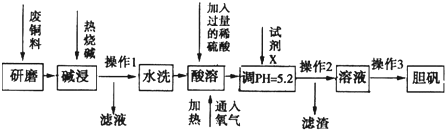
(5)依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是 (填序号)。
A.电极X的材料是Fe
B.电解质溶液Y是AgNO3溶液
C.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中
D.原电池工作时,x电极反应为:O2+2H2O+4e-→4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
金属单质及其化合物与工农业生产、日常生活有密切的联系。请回答下列问题:

(2)一定温度下,氧化铁可以与一氧化碳发生如下反应:

①该温度时,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,5 min后,生成了单质铁11.2 g,则这段时间内CO的反应速率为 ;
②达平衡后,若温度升高,的值增大,则Q 0(填“>”、“=”、“<”)。
(3)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的。如是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol·L-1)。若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为 (填序号)。

A.小于l B.4左右 C.大于6 D.大于9
(4)某工业废水中含有Cu2+、Pb2+、Hg2+,若向工业废水中加入过量的FeS,当FeS、CuS、PbS和HgS共存时,溶液中c(Fe2+):c(Pb2+):c(Hg2+)= : : 。
已知:Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(PbS)=3.4×10-28mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2,Ksp(HgS)=6.4×10-53mol2·L-2
(5)依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是 (填序号)。

A.电极X的材料是Fe
B.电解质溶液Y是AgNO3溶液
C.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中
D.原电池工作时,x电极反应为:O2+2H2O+4e-→4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com